题目内容
【题目】下列说法中,正确的是( )
A.1molH2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热
B.△H>0kJmol-1表示放热反应,![]() <0kJmol-1表示吸热反应
<0kJmol-1表示吸热反应
C.热化学方程式中的化学计量数表示物质的量,可以是分数
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热
【答案】C
【解析】
A.1mol![]() 与1
与1![]() 反应生成水的物质的量不是1mol,且钡离子与硫酸根反应生成硫酸钡沉淀,也有热量放出,故A错误;
反应生成水的物质的量不是1mol,且钡离子与硫酸根反应生成硫酸钡沉淀,也有热量放出,故A错误;
B.焓变![]() 表示吸热反应,
表示吸热反应,![]() ,表示放热反应,故B错误;
,表示放热反应,故B错误;
C.热化学方程式中的化学计量既表示物质的量也可以表示个数,所以可以是分数,故C正确;
D.H2的燃烧热是指在![]() ,
,![]() 时,1molH2完全燃烧生成液态水所释放的能量,故D错误;
时,1molH2完全燃烧生成液态水所释放的能量,故D错误;
故答案为C。

【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
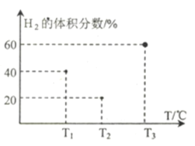
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。

A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量