题目内容
20.C3H8的结构式为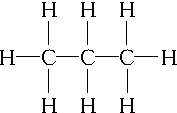 ,C3H6的同分异构体为CH2═CH-CH3、
,C3H6的同分异构体为CH2═CH-CH3、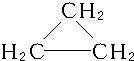 .
.
分析 用短线代替一对共用电子得结构式,根据分子式可知,该物质可能为烯烃或环烷烃,据此写出同分异构体.
解答 解:C3H8属于烷烃,碳碳键和碳氢键都为单键,结构式为; ;分子式符合C3H6的物质,可以为烯烃,也可以为环烷烃,结构简式为:CH2═CH-CH3、
;分子式符合C3H6的物质,可以为烯烃,也可以为环烷烃,结构简式为:CH2═CH-CH3、 ;故答案为:
;故答案为: ;CH2═CH-CH3、
;CH2═CH-CH3、 .
.
点评 本题考查了同分异构体的书写及结构式的书写,较基础,注意同分异构体书写方法.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
5.W、X、Y、Z是元素周期表中前四周期的四种元素,它们的原子序数依次递增.请结合下表中的信息,回答下列问题:
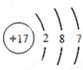
(1)W的第一电离能大于其同周期相邻的元素的原因是氮元素的原子核外2p能级的电子排布处于半满状态比较稳定;Z3+的M层电子数为13.
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
12.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,下列叙述中正确的是( )
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 氮化铝中N的化合价为-3价 | |
| C. | 因为具有抗冲击、导热性好等优良性能,所以氮化铝属于金属材料 | |
| D. | 合成氮化铝的反应符合“绿色化学”的思想 |
 .
. .
.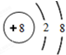
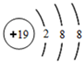 .
.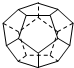 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有12个正五边形,共有30条棱边,C20晶体属于分子晶体 (填晶体类型).
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有12个正五边形,共有30条棱边,C20晶体属于分子晶体 (填晶体类型).
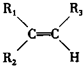 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$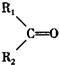 +R3COOH
+R3COOH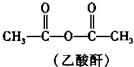 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CH3COOH
+CH3COOH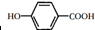
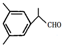
 ;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.
;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.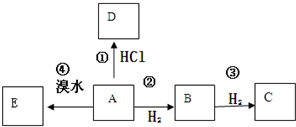 B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应.
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应.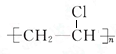 .
.