题目内容
12.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,下列叙述中正确的是( )| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 氮化铝中N的化合价为-3价 | |
| C. | 因为具有抗冲击、导热性好等优良性能,所以氮化铝属于金属材料 | |
| D. | 合成氮化铝的反应符合“绿色化学”的思想 |
分析 Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为氧化剂,反应中产生有毒气体,据此解答.
解答 解:A.在氮化铝的合成反应中,N2是氧化剂,Al2O3既不是氧化剂,也不是还原剂,故A错误;
B.氮化铝中Al的化合价为+3价,则N的化合价为-3价,故B正确;
C.氮化铝属于原子晶体,耐高温,硬度大,是化合物,不是金属材料,故C错误;
D.反应生成污染性气体CO,不符合“绿色化学”思想,故D错误;
故选B.
点评 本题考查氧化还原反应,题目难度不大,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查.

练习册系列答案
相关题目
2.北京2008年奥运会在开幕式之前举行的隆重的火炬接力仪式.火炬的可燃物为丁烷(C4H10).下列关于丁烷的说法中,不正确的是( )
| A. | 丁烷中碳、氢原子的个数比为4:10 | |
| B. | 丁烷中碳、氢两种元素的质量比是4:10 | |
| C. | 丁烷由碳、氢两种元素组成 | |
| D. | 一个丁烷分子由4个碳原子和10个氢原子构成 |
3.荧光素是发光物质的基质,5-羧基荧光素与5-羧基荧光素二乙酸酯在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等.下列说法正确的是( )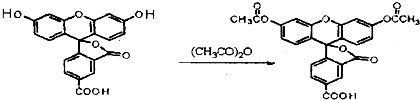
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
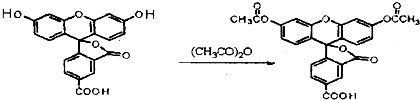
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
| A. | 5-FAM转变为5-CFDA属于取代反应 | |
| B. | 实验室鉴别5-FAM与5-CFDA可用碳酸氢钠溶液 | |
| C. | 5-FAM的分子式为:C21H3O7 | |
| D. | 5-FAM和5-CFDA分子中的所有原子均共面 |
7.FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验.已知SO3的熔点是16.8℃,沸点是44.8℃.
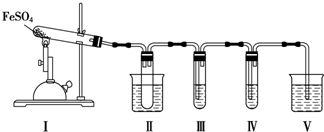
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.

请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.
17.下列说法正确的是 ( )
| A. | 同一主族元素,原子半径越大,其单质的熔点不一定越高 | |
| B. | 全部由非金属元素组成的化合物中一定只有共价键 | |
| C. | 在由锌片、铜片、稀硫酸组成的原电池中,电子由铜片经外电路流向锌片 | |
| D. | 氯化钠和氯化氢分别溶解在水中所克服的粒子间相互作用属于同种类型 |
4.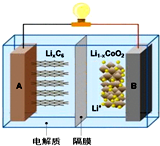 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )| A. | 放电时电子从A极通过导线流向B极有关 | |
| B. | 放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ | |
| C. | 充电时Li+从左边流向右边 | |
| D. | 充电时B作阳极,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
1.下列说法不正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
2.乙烯保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等.工业上以乙烯和氯气为主要原料来合成PE和PVC的流程如下所示.下列说法正确的是( )
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
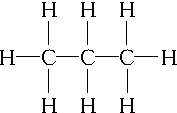 ,C3H6的同分异构体为CH2═CH-CH3、
,C3H6的同分异构体为CH2═CH-CH3、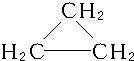 .
.