题目内容
4.某同学将Fe+2FeCl3=3FeCl2设计成原电池装置如图所示.下列说法正确的是( )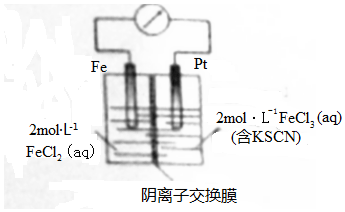
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |
分析 根据反应“Fe+2FeCl3═3FeCl2”可知,反应中Fe被氧化,应为原电池负极,失电子而被氧化,正极应为Pt,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,原电池中阳离子移向正极,阴离子移向负极,电子从负极经导线流向正极,据此分析.
解答 解:A、电子不能从溶液中转移,故A错误;
B、Fe3+在正极得到电子而被还原,Fe3+浓度减小,左侧溶液中铁离子不能通过阴离子交换膜,所以右侧溶液颜色变浅,故B正确;
C、正极电极反应式为Fe3++e-=Fe2+,故C错误;
D、右侧为正极,电极反应式为Fe3++e-=Fe2+,所以转移2mole-,交换膜右侧溶液中约减少2mol离子,故D错误;
故选B.
点评 本题考查原电池的工作原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的良好的科学素养,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
18. (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
A.若υ正(O2)=2υ逆(SO3),说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后移动活塞压缩气体,达到新平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.达平衡后,保持温度和容器体积不变,再充入2mol SO2,化学平衡向右移动,SO2的转化率增大.
(2)尾气SO2用NaOH溶液吸收后会生成Na2SO3.,实验测定常温下0.1mol/L Na2SO3溶液的pH为8,该溶液中由水电离出的氢氧根离子的浓度为10-6.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如下.
①上述反应中,△H1>0(选填:“>”或“<”).其原因是温度升高,平衡常数增大.
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1=lgK2-lgK3(用lgK2和lgK3来表示).
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.A.若υ正(O2)=2υ逆(SO3),说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后移动活塞压缩气体,达到新平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.达平衡后,保持温度和容器体积不变,再充入2mol SO2,化学平衡向右移动,SO2的转化率增大.
(2)尾气SO2用NaOH溶液吸收后会生成Na2SO3.,实验测定常温下0.1mol/L Na2SO3溶液的pH为8,该溶液中由水电离出的氢氧根离子的浓度为10-6.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如下.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1=lgK2-lgK3(用lgK2和lgK3来表示).
15.常温下,某NH4Cl溶液的pH=4,下列说法中正确的是( )
①溶液中c(H+)>c(OH-);
②由水电离产生的c(H+)约为10-10mol/L;
③溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
④在纯水中加入该NH4Cl溶液,水的电离被抑制.
①溶液中c(H+)>c(OH-);
②由水电离产生的c(H+)约为10-10mol/L;
③溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
④在纯水中加入该NH4Cl溶液,水的电离被抑制.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
9.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 硅的性质较稳定,在自然界中存在游离态的硅 | |
| B. | 陶瓷、水泥、玻璃、金刚砂均为传统无机非金属材料 | |
| C. | 水泥、普通玻璃的制备均要用到石灰石 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液无影响 |
16.下列反应中,反应后固体物质质量不变的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
14.下列金属氧化物均可由铝热反应制取相应的金属,其中金属化合价最低为( )
| A. | MnO2 | B. | WO3 | C. | Cr2O3 | D. | Co3O4 |

 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH
 .⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种.
.⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种. .
. .
. .
.

 .
. 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.