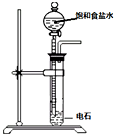
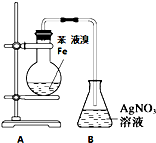
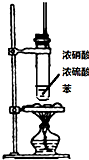
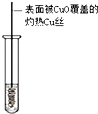
题目内容
14.下列金属氧化物均可由铝热反应制取相应的金属,其中金属化合价最低为( )| A. | MnO2 | B. | WO3 | C. | Cr2O3 | D. | Co3O4 |
分析 在化合物中正负化合价代数和为0,在氧化物中氧元素的化合价一般为-2价,据此判断即可.
解答 解:A、O为-2价,则Mn为+4价;
B、O为-2价,则W为+6价;
C、O为-2价,则Cr为+3价;
D、O为-2价,则Co为+$\frac{8}{3}$价,故最低的是D,故选D.
点评 本题难度不大,主要考查的是化合物中元素化合价的判断,依据在氧化物中O常见价态为-2价,利用代数和为0计算是关键.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
4.某同学将Fe+2FeCl3=3FeCl2设计成原电池装置如图所示.下列说法正确的是( )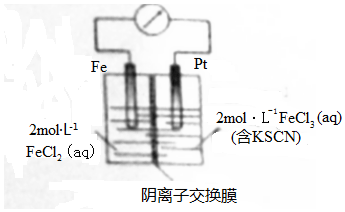

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |
5.FeCl3溶液和Fe(OH)3胶体共同具备的特性是( )
| A. | 分散质粒子的直径小于1nm | B. | 都是红褐色 | ||
| C. | 都有丁达尔效应 | D. | 都比较稳定 |
2.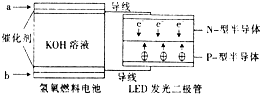 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )| A. | a处通入氢气,发生还原反应 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | 该装置中只涉及两种形式的能量转化 | |
| D. | P-型半导体连接的是电池负极 |
9.为实现下列实验目的,如表提供的主要仪器以及所用试剂均合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 测定中和热 | 烧杯、玻璃棒、纸板、保温塑料、温度计 | 50mL0.5mol/LNaOH溶液与50mL0.5mol/L盐酸 |
| C | 测定生成H2速率 | 分液漏斗、锥形瓶、针筒、铁架台 | Zn粒、稀硫酸 |
| D | 浓硫酸脱水性 | 分液漏斗、试管 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
19.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+ | |
| B. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- | |
| C. | 滴入甲基橙显黄色的溶液中:Na+、ClO-、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Na+、NO3-、CH3COO- |
4. 对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
 对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )| A. | 增大N2的浓度 | B. | 升高温度 | C. | 增大压强 | D. | 增大NH3的浓度 |

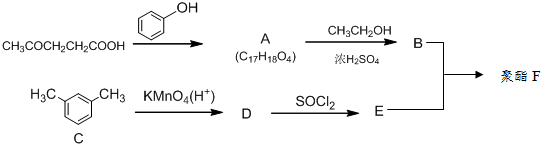
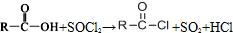 ②
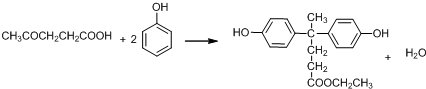
② (R、R′表示烃基)
(R、R′表示烃基)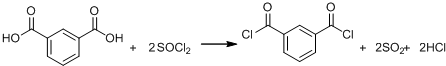
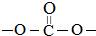 结构.
结构.