题目内容
16.下列反应中,反应后固体物质质量不变的是( )| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
分析 A.氢气与CuO的反应生成Cu和水;
B.二氧化碳与过氧化钠的反应生成碳酸钠和氧气;
C.Al与Fe2O3反应生成Al2O3和Fe;
D.Zn与Cu(NO3)2反应生成Zn(NO3)2和Cu.
解答 解:A.氢气与CuO的反应生成Cu和水,反应前固体为CuO,反应后固体为Cu,固体质量减小,故A错误;
B.二氧化碳与过氧化钠的反应生成碳酸钠和氧气,反应前固体为过氧化钠,反应后固体为碳酸钠,二者物质的量相同,固体质量增加,故B错误;
C.Al与Fe2O3反应生成Al2O3和Fe,反应前固体为氧化铁、Al,反应后固体为氧化铝、Fe,均为固体,固体质量不变,故C正确;
D.Zn与Cu(NO3)2反应生成Zn(NO3)2和Cu,反应前固体为Zn,反应后固体为Cu,二者物质的量相同,则固体质量减小,故D错误;
故选C.
点评 本题为2014年高考试题,把握发生的化学反应及反应前后固体的分析为解答的关键,侧重元素化合物性质的考查,注意反应中物质的质量变化,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
10.a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族.c原子核内质子数等于a、b原子核内质子数之和,c原子最外层上的电子数是d原子次外层电子数的一半.下列说法中正确的( )
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
7.X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,Y元素的单质常通过分离液态空气得到,Z元素的单质是常见的半导体材料,W与Z同族,R与Y同族,其单质有杀菌作用. 下列叙述不正确的是( )
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| B. | 根据非金属性强弱,不可能由Z的最高价氧化物制出W的最高价氧化物 | |
| C. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| D. | 向两份BaCl2溶液中分别通入RY2、WY2,均无白色沉淀生成,但一段时间后,通入RY2的一份中可能产生沉淀 |
4.某同学将Fe+2FeCl3=3FeCl2设计成原电池装置如图所示.下列说法正确的是( )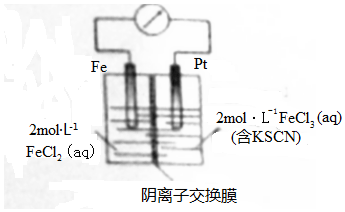

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |
11.下列实验操作与预期实验目的或所得实验结论都正确的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
1.化学与生产、生活密切相关,下列说法错误的是( )
| A. | 铝需经过特别处理才具有抗腐蚀能力 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | Li是最轻的金属也是活动性很强的金属,是制造电池的理想物质 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
8.用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
5.FeCl3溶液和Fe(OH)3胶体共同具备的特性是( )
| A. | 分散质粒子的直径小于1nm | B. | 都是红褐色 | ||
| C. | 都有丁达尔效应 | D. | 都比较稳定 |

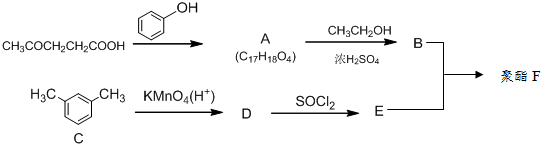
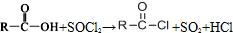 ②
② (R、R′表示烃基)
(R、R′表示烃基)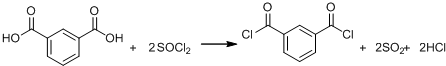
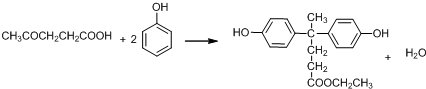
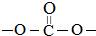 结构.
结构.