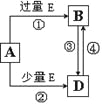
��Ŀ����
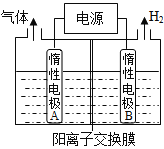
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6 mol��L��1��H2SO4��Һ�У���ͬѧ���缫����6 mol��L��1��NaOH��Һ�У���ͼ��ʾ��
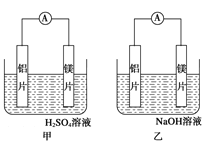
��1��д�����������ĵ缫��Ӧʽ_____________________________��
��2��д����������ܷ�Ӧ�����ӷ���ʽ�� ___________________��
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������á�������жϳ�________����дԪ�ط��ţ���ͬ���Ľ��������ǿ�����һ��жϳ�________�Ľ�����Ը�ǿ��
��4���ɴ�ʵ����������������Щ��ȷ����
A������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B��þ�Ľ�����Բ�һ�������Ľ������ǿ
C����ʵ��˵���������˳����ѹ�ʱ����û��ʹ�ü�ֵ
D����ʵ��˵����ѧ�о������ӡ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳���ж�ԭ����е�������������������_________(��ɿ������ɿ���)���粻�ɿ������������һ���ж�ԭ������������Ŀ���ʵ��___________ (��ɿ����ɲ���д)��
��6����5.1gþ���Ͻ�����60mL 5.0 mol��L��1H2SO4��Һ�У���ȫ�ܽ���ټ���65mL 10.0mol��L��1��NaOH��Һ���õ�����������Ϊ9.7g�������μ�NaOH��Һʱ��������١�
�������� mL NaOH��Һʱ����ʹ�ܽ��������Mg2+��Al3+ǡ����ȫ������
���Ͻ���������ʱ�������������ڱ�״���µ����Ϊ L��
���𰸡�
��1�� 2H����2e��=H2����
��2�� 2Al��2OH-��2H2O=2AlO2-��3H2����
��3�� Mg�� Al������4�� AD��
��5�� ���ɿ����������������õ��ߴ����������ϣ�ͨ����������ָ��ƫת�жϵ���������������������
��6�� 60�� 5.6��
��������
�����������1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪMg-2e- =Mg2+��������ӦΪ2H����2e��=H2������2���ҳ�������ʧ��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Al+4OH- -3e- =AlO2 - +2H2O��þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al��2OH-��2H2O=2AlO2-��3H2������3������þ���������������������������������Ľ���������ǿ�жϣ�����þ���ǿ�����������ǿ����4��A�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ���ȷ��B.þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ�����C.��ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ������D.��ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ������������������ȷ����5������ʵ��Ҳ������֤���ˡ�ֱ�����ý������˳���ж�ԭ����е����������������������ɿ����粻�ɿ�����һ���ж�ԭ������������Ŀ���ʵ���ǽ������������õ��ߴ����������ϣ�ͨ����������ָ��ƫת�жϵ�����������������������6���������ķ�ӦΪ��Mg+ H2SO4=MgSO4 +H2����2Al+3H2SO4=Al2 (SO4 )3 +3H2����MgSO4 +2NaOH=Mg(OH)2��+Na2SO4 ��Al2 (SO4 )3 +6NaOH =2Al(OH)3��+3Na2SO4�� ��n(H2SO4)=0.06L��5mol/L=0.3mol���������е�Mg2+��Al3+ǡ����ȫ����ʱ����Һ�ɷ�ΪNa2SO4����ʱn(NaOH)=2n(H2SO4)=2��0.3mol=0.6mol������V(NaOH)= 0.6mol��10mol/L =0.06L=60ml����������60mlNaOH��Һʱ��þ���ӡ�������ǡ�ó�����������n(NaOH)= 0.065L�� 10mol/L=0.65molʱ��NaOH������n(NaOH)(����)=0.65mol-0.6mol=0.05mol��������Al(OH)3+NaOH =NaAlO2 +2H2O�����ܽ��n[Al(OH)3]=0.05mol��m(Al(OH)3)=0.05mol��78g/mol=3.9g�����������е�Mg��Alǡ����ȫ����������ӦΪ3.9g+9.7g=13.6g���������к���xmolMg��ymolAl����24x+27y��5.1g��58x+78y��13.6g����֮�ã�x=0.1��y=0.1�����Ը��ݵ����غ�ɵ÷�Ӧ�������������ʵ�����n(H2)=x+3/2y=0.1mol+0.15mol=0.25mol��V(H2)=0.25mol��22.4L/mol=5.6L��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�