题目内容
3.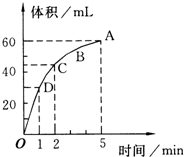 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:(1)5分钟内的平均反应速率为12mL/min
(2)放出一半气体时所需时间1min
(3)D、C、B、A四点化学反应速率逐渐减慢(加快或减慢),解释原因反应物浓度减小,反应速率减慢
(4)写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
分析 (1)5分钟内的平均反应速率,根据v=$\frac{△V}{△t}$计算求解;
(2)放出一半气体也就是30ml,由图可知30ml体积,对应的时间为:1min;
(3)随时间的推移,反应物过氧化氢的浓度逐渐减小,浓度越小反应速率越慢;
(4)过氧化氢分解的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
解答 解:(1)5分钟内的平均反应速率,根据v=$\frac{△V}{△t}$=$\frac{60mL}{5min}$=12mL/min,故答案为:12;
(2)放出一半气体也就是30ml,由图可知30ml体积,对应的时间为:1min,故答案为:1;
(3)随时间的推移,反应物过氧化氢的浓度逐渐减小,浓度越小反应速率越慢,所以D、C、B、A四点化学反应速率逐减慢,故答案为:减慢;反应物浓度减小,反应速率减慢;
(4)过氧化氢分解的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
点评 本题考查过氧化氢分解的速率曲线,题目难度中等,主要考查浓度对反应速率的影响、有关方程式的计算等,正确分析图象的曲线变化是解答本题的关键.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
12.下列排列顺序正确的是( )
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
11.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量筒、250mL容量瓶、胶头滴管;
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

18.下列说法正确的是( )


| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
8. 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
 粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )
粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是( )| A. | 甲池中电解质溶液的pH值减小 | |
| B. | 乙池中CuSO4溶液的浓度不变 | |
| C. | 甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| D. | 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O═CO32-+8H+ |
12. 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加入AgNO3,可以使溶液由c点变到d点 | |
| B. | 加入少量水,平衡右移,Cl-浓度减小 | |
| C. | d点没有AgCl沉淀生成 | |
| D. | c点对应的Ksp等于a点对应的Ksp |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.
化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.