题目内容
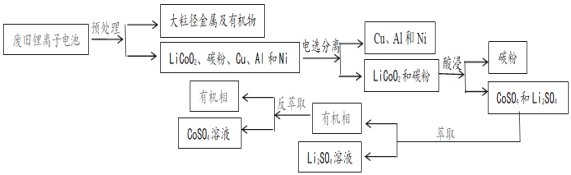
【题目】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________,写出浸出CoSO4的离子反应方程式:__________________
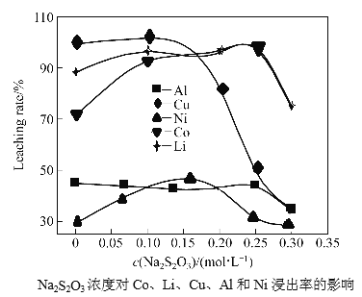
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________(用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________(填操作)得Li2CO3粉末。
【答案】C 提高LiCoO2的浸出率和浸出速率 8LiCoO2+S2O32-+22H+=8Li++8Co2++11H2O+2SO42- 0.25 Na2S2O3+H2SO4= Na2SO4+S↓+ SO2↑+ H2O,反应中产生硫单质,附着在固体表面阻止反应进行 有机萃取剂(有机相) 1.48 趁热过滤,洗涤,干燥
【解析】
废旧锂离子电池处理拆解后分离出LiCoO2、碳粉、Cu、Al、Ni等小颗粒混合物,通过电选将LiCoO2、碳粉与Cu、Al、Ni分离,向LiCoO2、碳粉混合物中加入硫酸,碳不与硫酸反应,过滤可得硫酸钴和硫酸锂溶液,得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液,据此分析解答。
(1) A.根据锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1),放电时,则Li1-xCoO2为正极,LixC6为负极,负极LixC6失去电子得到Li+,在原电池中,阳离子移向正极,则Li+在电解质中由负极向正极迁移;充电时,石墨(C6)电极变成LixC6,电解池中阳离子向阴极移动,阴极电极反应式为:xLi++C6+xe-═LixC6,则石墨(C6)电极增重的质量就是锂离子的质量,则锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌,故A正确;
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,根据流程图,放电处理”有利于锂的回收,故B正确;
C.充电时,石墨(C6)电极变成LixC6,电极反应式为:xLi++C6+xe-═LixC6,则石墨(C6)电极增重的质量就是锂离子的质量,根据关系式:xLi+~~xe-,可知若转移0.01mole-,就增重0.01molLi+,即0.07g,故C错误;
D.正极上Co元素化合价降低,放电时,电池的正极反应为:Li1-xCoO2+xLi++xe-═LiCoO2,充电是放电的逆反应,故D正确;
答案选C;
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,Na2S2O3是一种中等强度的还原剂,二者发生氧化还原反应有利于提高酸浸时LiCoO2的浸出率和浸出速率,浸出CoSO4的离子反应方程式:8LiCoO2+S2O32-+22H+=8Li++8Co2++11H2O+2SO42-;
(3)通过酸浸,加入Na2S2O3溶液,将Cu、Al、Ni与Li、Co分离,提高Li、Co离子的浸出率,当Li、Co离子的浸出率最高时,Na2S2O3溶液的浓度为0.25mol/L;Na2S2O3溶液浓度增至0.3mol/L时,Na2S2O3是一种中等强度的还原剂,遇强酸分解,发生反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,反应中产生硫单质,附着在固体表面阻止反应进行,导致LiCoO2的浸出率明显下降;
(4)整个回收工艺中,通过反萃取,可以再生有机萃取剂(有机相),该有机相可循环使用流程中萃取环节;
(5)溶解度是指一定温度下达到饱和时,100g水中溶解溶质的质量,15℃左右,100g水的体积100mL,根据Li2CO32Li++CO32-,c(Li+)=2c(CO32-),Ksp(Li2CO3)= c2(Li+)×c(CO32-)=[2c(CO32-)]2×c(CO32-)=4[c(CO32-)]3=3.210-2,c(CO32-)=![]() =0.2mol/L,则溶解的Li2CO3的物质的量=0.2mol/L×0.1L=0.02mol,溶解的Li2CO3的质量=0.02mol×74g/mol=1.48g;将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,Li2CO3溶解度随温度升高而减小,应趁热过滤,洗涤,干燥获得Li2CO3粉末。
=0.2mol/L,则溶解的Li2CO3的物质的量=0.2mol/L×0.1L=0.02mol,溶解的Li2CO3的质量=0.02mol×74g/mol=1.48g;将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,Li2CO3溶解度随温度升高而减小,应趁热过滤,洗涤,干燥获得Li2CO3粉末。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下合成甲醇,发生的反应为CO(g)+2H2(g)![]() CH3OH(l) ΔH=?
CH3OH(l) ΔH=?
(1)已知CO、H2、CH3OH的燃烧热分别为283.0kJ·mol-1、285.8kJ·mol-1、726.5kJ·mol-1,则ΔH=__。
(2)在一容积为2L的恒容密闭容器中加入0.2molCO和0.4molH2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
时间 温度/℃ | 10min | 20min | 30min | 40min | 50min | 60min |
T1 | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
T2 | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
①由上述数据可以判断:T1__T2(填“>”“<”或“=”)。
②T1℃时,0~20minH2的平均反应速率v(H2)=__。
③该反应在T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是__(填字母)。
A.改用高效催化剂
B.升高温度
C.缩小容器容积
D.分离出甲醇
E.增加CO的浓度
(3)若保持T2℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应满足的条件:__。
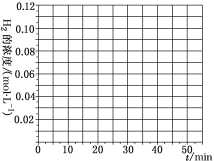
(4)当反应在T1℃进行20min时,迅速将0.02molCO、0.04molH2、0.18molCH3OH同时投入体系中,同时将反应体积扩大为原来的2倍,反应在40min时达到平衡,请在图中画出20~40min内容器中H2浓度的变化趋势曲线___。
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为__(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
【题目】某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。下列说法正确的是
试管 | ① | ② | ③ | ④ |
实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |
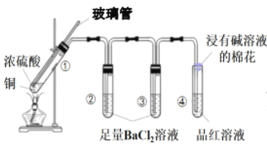
A.②中白色沉淀是BaSO3
B.①中可能有部分浓硫酸挥发了
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【题目】有机物A的相对分子质量不超过150,经测定可知A具有下列性质:
A所具有的性质 | 由此推出的A的组成或结构 |
①A能燃烧,燃烧产物只有CO2和H2O | |
②A与醇或羧酸在浓硫酸存在条件下发生反应均能生成有香味的物质 | |
③在一定条件下,A能发生分子内的脱水反应,生成物能使溴的CCl4溶液退色 | |
④0.1 mol A与足量NaHCO3溶液反应放出标准状况下4.48L气体 |
(1)填写表中空白_____________、__________________ 、_______________________。
(2)已知A分子中氧元素的质量分数为59.7%,则A的分子式为______________。
(3)假设A的结构式中不含碳支链,写出③中A所发生反应的化学方程式:__________________。



