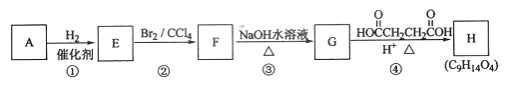
题目内容
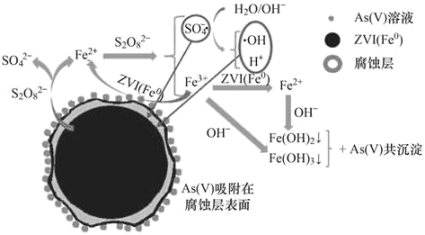
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。Ksp[Fe(OH)3]=2.7×10-39,下列叙述错误的是
A.pH越小,越有利于去除废水中的正五价砷
B.1mol过硫酸钠(Na2S2O8)含NA个过氧键
C.碱性条件下,硫酸根自由基发生反应的方程式为:SO4-+ OH- = SO42-+OH
D.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)约为2.7×10-18mol·L-1
【答案】A
【解析】
A.pH越小,酸性越强,会使Fe(OH)3(s)Fe3+(aq)+3OH-(aq)和Fe(OH)2(s)Fe2+(aq)+2OH-(aq)平衡右移,无法生成沉淀,不利于除去废水中的正五价砷,故A错误;
B.设1mol过硫酸钠(Na2S2O8)中过氧键物质的量为amol,钠为+1价,硫为+6价,过氧键中的氧为-1价,非过氧键中的氧为-2价,则(+1)×2+(+6)×2+(-2) ×a+(-2) ×(8-2a)=0,解得a=1,所以1mol过硫酸钠(Na2S2O8)中过氧键的数量为NA,故B正确;
C.由图示可得,碱性条件下,硫酸根自由基发生反应的方程式为:SO42-+ OH- = SO42-+OH,故C正确;
D.Fe(OH)3溶于水存在沉淀溶解平衡:Fe(OH)3(s)Fe3+(aq)+3OH-(aq),此溶液碱性极弱,pH接近7,即c(OH-)=1×10-7mol/L,因为Ksp(Fe(OH)3)= c(Fe3+)×c3(OH-)=2.7×10-39,则c(Fe3+)=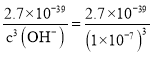 =2.7×10-18mol·L-1,故D正确;
=2.7×10-18mol·L-1,故D正确;
答案选A。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目