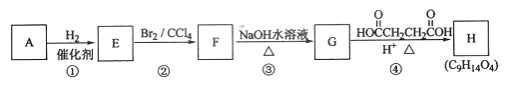
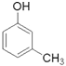
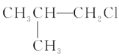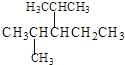题目内容
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
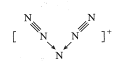
A.每个Ns+中含有35个质子和36个电子B.该离子中只含有非极性键
C.该离子中含有2个π键D.![]() 与
与![]() 互为等电子体
互为等电子体
【答案】B
【解析】
A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的;
B.同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性共价键,含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键;
C.1个氮氮三键中含有2个π键;
D.根据具有相同原子数和价电子数的微粒互称为等电子体。
A.1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有35个质子,34个电子,故A错误;
B. N5+中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的两个氮原子提供孤电子对形成配位键,故B正确;
C.1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C错误;
D. N5+和![]() 具有相同原子数,但价电子数分别为24,32,不是等电子体,故D错误;
具有相同原子数,但价电子数分别为24,32,不是等电子体,故D错误;
故答案选:B。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。
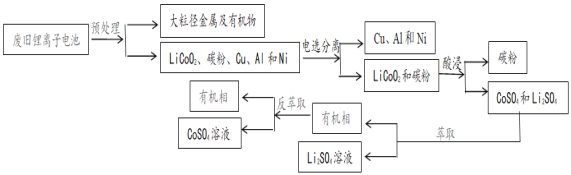
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
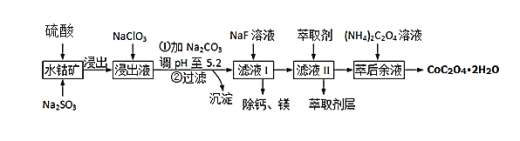
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
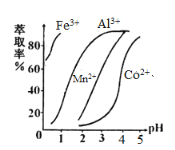
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随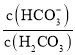 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.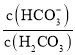 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度