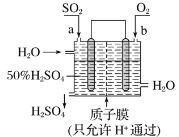
МвДїДЪИЭ
ЎѕМвДїЎїКµСйКТСёЛЩЦЖ±ёЙЩБїВИЖшїЙАыУГИзПВ·ґУ¦ЈєKMnO4+HCl(ЕЁ)ЎъKCl+MnCl2+Cl2Ўь+H2O(ОґЕдЖЅ)Ј¬ґЛ·ґУ¦іЈОВПВѕНїЙТФСёЛЩЅшРРЎЈЅбєПРЕПўЈ¬»ШґрПВБРОКМвЈє
ЈЁ1Ј©ЙПКц·ґУ¦ЦР±»Сх»ЇµДФЄЛШОЄ___Ј¬»№ФІъОпКЗ___ЎЈ
ЈЁ2Ј©Fe2+ТІДЬУлMnO4-·ґУ¦ЙъіЙMn2+Ј¬·ґУ¦єуFe2+ЧЄ»ЇОЄ__ЎЈ·ґУ¦ЦРFe2+±нПЦ__(МоЎ°Сх»ЇЎ±»тЎ°»№ФЎ±)РФЎЈ
ЈЁ3Ј©Из№ыЙПКц»ЇС§·ЅіМКЅЦРKMnO4єНMnCl2µД»ЇС§јЖБїКэ¶јКЗ2Ј¬ФтHClµД»ЇС§јЖБїКэКЗ___ЎЈ
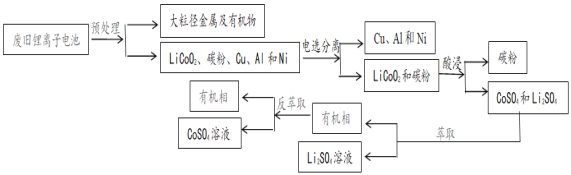
ЈЁ4Ј©КµСйКТНЁіЈАыУГMnO2УлЕЁСОЛб№ІИИ·ґУ¦ЦЖµГВИЖшЈ¬ѕЭґЛїЙЦЄKMnO4ЎўCl2ЎўMnO2ИэЦЦОпЦКµДСх»ЇРФУЙЗїµЅИхµДЛіРтОЄ___ЎЈ
Ўѕґр°ёЎїCl MnCl2 Fe3+ »№Ф 16 KMnO4>MnO2>Cl2
ЎѕЅвОцЎї
KMnO4+HClЎъKCl+MnCl2+Cl2+H2OЦРЈ¬MnФЄЛШµД»ЇєПјЫУЙ+7јЫЅµµНОЄ+2јЫЈ¬ClФЄЛШµД»ЇєПјЫУЙ-1јЫЙэёЯОЄ0Ј¬ЅбєПСх»Ї»№Ф·ґУ¦µД№жВЙєН»ЇєПјЫЙэЅµКШєг·ЦОцЅвґр(1)Ў«(3)Ј¬ёщѕЭСх»ЇјБµДСх»ЇРФґуУЪСх»ЇІъОпµДСх»ЇРФј°·ґУ¦МхјюµДДСТЧ·ЦОцЕР¶ПСх»ЇРФµДЗїИхЈ¬ѕЭґЛЅвґр(4)ЎЈ
(1)KMnO4+HCl(ЕЁ)ЎъKCl+MnCl2+Cl2Ўь+H2O ·ґУ¦ЦРMnФЄЛШµД»ЇєПјЫЅµµНЈ¬ClФЄЛШµД»ЇєПјЫЙэёЯЈ¬ФтKMnO4ОЄСх»ЇјБЈ¬ЙъіЙµДMnCl2ОЄ»№ФІъОпЈ»ClФЄЛШ±»Сх»ЇЈ¬№Кґр°ёОЄЈєClЈ»MnCl2Ј»
(2)Fe2+ТІДЬК№KMnO4·ґУ¦ЙъіЙMnCl2Ј¬ФтMnФЄЛШµД»ЇєПјЫУЙ+7јЫЅµµНОЄ+2јЫЈ¬ёщѕЭµГК§µзЧУКШєгЈ¬Fe2+»ЇєПјЫУЙ+2јЫЙэёЯОЄ+3Ј¬ЙъіЙFe3+Ј¬ЛщТФFe2+ѕЯУР»№ФРФЈ¬·ўЙъСх»Ї·ґУ¦Ј¬№Кґр°ёОЄЈєFe3+Ј»»№ФЈ»
(3)Из№ыёГ·ґУ¦·ЅіМКЅЦРKMnO4єНMnCl2µДПµКэ¶јКЗ2Ј¬ёщѕЭµГК§µзЧУКШєгЈ¬ФтCl2µДПµКэКЗ![]() =5Ј¬ФЩёщѕЭВИФЧУКШєгЈ¬ФтHClµДПµКэКЗ5ЎБ2+2ЎБ2+1ЎБ2=16Ј¬№Кґр°ёОЄЈє16Ј»
=5Ј¬ФЩёщѕЭВИФЧУКШєгЈ¬ФтHClµДПµКэКЗ5ЎБ2+2ЎБ2+1ЎБ2=16Ј¬№Кґр°ёОЄЈє16Ј»
(4)ёщѕЭСх»ЇјБµДСх»ЇРФґуУЪСх»ЇІъОпµДСх»ЇРФЈ¬ЛщТФKMnO4+HClЎъKCl+MnCl2+Cl2+H2OЦРСх»ЇРФУЙЗїµЅИхµДЛіРтKMnO4ЈѕCl2Ј¬УЦ·ґУ¦MnO2+4H++2Cl- ![]() Mn2++Cl2Ўь+2H2OЈ¬Сх»ЇРФУЙЗїµЅИхµДЛіРтОЄMnO2ЈѕCl2Ј¬ёЯГМЛбјШФЪіЈОВПВСх»ЇЕЁСОЛбЈ¬¶юСх»ЇГМФЪјУИИМхјюПВСх»ЇЕЁСОЛбЈ¬ЛµГчёЯГМЛбјШСх»ЇРФґуУЪ¶юСх»ЇГМЈ¬ФтMnO2ЎўCl2ЎўKMnO4ИэЦЦОпЦКСх»ЇРФУЙЗїµЅИхµДЛіРтОЄKMnO4ЈѕMnO2ЈѕCl2Ј¬№Кґр°ёОЄЈєKMnO4ЈѕMnO2ЈѕCl2ЎЈ
Mn2++Cl2Ўь+2H2OЈ¬Сх»ЇРФУЙЗїµЅИхµДЛіРтОЄMnO2ЈѕCl2Ј¬ёЯГМЛбјШФЪіЈОВПВСх»ЇЕЁСОЛбЈ¬¶юСх»ЇГМФЪјУИИМхјюПВСх»ЇЕЁСОЛбЈ¬ЛµГчёЯГМЛбјШСх»ЇРФґуУЪ¶юСх»ЇГМЈ¬ФтMnO2ЎўCl2ЎўKMnO4ИэЦЦОпЦКСх»ЇРФУЙЗїµЅИхµДЛіРтОЄKMnO4ЈѕMnO2ЈѕCl2Ј¬№Кґр°ёОЄЈєKMnO4ЈѕMnO2ЈѕCl2ЎЈ

 ¶б№ЪСµБ·µҐФЄЖЪД©іеґМ100·ЦПµБРґр°ё
¶б№ЪСµБ·µҐФЄЖЪД©іеґМ100·ЦПµБРґр°ё РВЛјО¬РЎ№Ъѕь100·ЦЧчТµ±ѕПµБРґр°ё
РВЛјО¬РЎ№Ъѕь100·ЦЧчТµ±ѕПµБРґр°ё ГыК¦ЦёµјТ»ѕнНЁПµБРґр°ё
ГыК¦ЦёµјТ»ѕнНЁПµБРґр°ёЎѕМвДїЎїПВБРНјПуЦРЈ¬ЧЭЧш±кОЄіБµнОпµДБїЈ¬єбЧш±кОЄИЬТєЦРјУИл·ґУ¦ОпµДОпЦКµДБїЈ¬КФ°ґМвТвЅ«НјПуЦРПаУ¦µДКэЧЦРтєЕМоИл±нЦРµДЛіРтОЄ
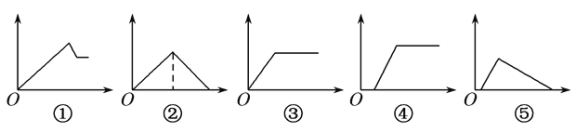
ИЬТє | јУИлОпЦК | ПаУ¦РтєЕ |
(1)ВИ»ЇВБИЬТє | јУИл№эБї°±Л® | |
(2)±ҐєНіОЗеКЇ»ТЛ® | НЁИл№эБїCO2ЖшМе | |
(3)є¬ЙЩБїNaOHµДЖ«ВБЛбДЖИЬТє | НЁИл№эБїCO2ЖшМе | |
(4)є¬ЙЩБїNaOHµДЖ«ВБЛбДЖИЬТє | ЦрµОјУИлПЎСОЛб | |
(5)MgCl2ЎўAlCl3µД»мєПИЬТє | ЦрµОјУИлNaOHИЬТєЦБ№эБї |
A. ўЩўЫўЪўЬўЭ B. ўЫўЭўЬўЪўЩ
C. ўЩўЪўЫўЬўЭ D. ўЫўЪўЬўЭўЩ
ЎѕМвДїЎїИЛМеСЄТєЦРґжФЪµДЖЅєвЈєH2CO3 ![]() HCO3-Ј¬К№СЄТєpH±ЈіЦФЪ7.35 ~ 7.45Ц®јдЈ¬·сФтѕН»б·ўЙъЛбЦР¶ѕ»тјоЦР¶ѕЎЈТСЦЄpHЛж
HCO3-Ј¬К№СЄТєpH±ЈіЦФЪ7.35 ~ 7.45Ц®јдЈ¬·сФтѕН»б·ўЙъЛбЦР¶ѕ»тјоЦР¶ѕЎЈТСЦЄpHЛж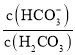 ±д»Ї№ШПµИз±нЛщКѕЈ¬ФтПВБРЛµ·ЁЦРґнОуµДКЗ
±д»Ї№ШПµИз±нЛщКѕЈ¬ФтПВБРЛµ·ЁЦРґнОуµДКЗ
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7µДСЄТєЦРЈ¬c(HCO3-)>c(H2CO3)
B.ХэіЈМеОВПВИЛМе·ўЙъјоЦР¶ѕК±Ј¬c(H+)c(OH-)±дґу
C.ИЛМе·ўЙъЛбЦР¶ѕК±Ј¬їЙѕІВцµОЧўТ»¶ЁЕЁ¶ИµДNaHCO3ИЬТєЅв¶ѕ
D.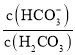 ЈЅ20.0К±Ј¬H2CO3µДµзАліМ¶ИРЎУЪHCO3-µДЛ®ЅвіМ¶И
ЈЅ20.0К±Ј¬H2CO3µДµзАліМ¶ИРЎУЪHCO3-µДЛ®ЅвіМ¶И
ЎѕМвДїЎїКµСйКТУГЙЩБїµДдеєНЧгБїµДТТґјЦЖ±ё1Ј¬2Т»¶юдеТТНйµДЧ°ЦГИзНјЛщКѕЈє

УР№ШКэѕЭБР±нИзПВЈє
ТТґј | 1.2¶юдеТТНй | ТТГС | |
ЧґМ¬ | ОЮЙ«ТєМе | ОЮЙ«ТєМе | ОЮЙ«ТєМе |
ГЬ¶И/g/cm©Ѓ3 | 0.79 | 2.2 | 0.71 |
·Рµг/Ўж | 78.5 | 132 | 34.6 |
ИЫµг/Ўж | ©Ѓ130 | 9 | ©Ѓ116 |
Зл°ґТЄЗу»ШґрПВБРОКМвЈє
ЈЁ1Ј©РґіцAЧ°ЦГЦРµД»ЇС§·ґУ¦·ЅіМКЅ_____Ј»
ЈЁ2Ј©Ч°ЦГCЦРКўУРЗвСх»ЇДЖИЬТєЈ¬ЖдЧчУГКЗ_____
ЈЁ3Ј©ФЪґЛЦЖ±ёКµСйЦРЈ¬ТЄѕЎїЙДЬСёЛЩµШ°С·ґУ¦ОВ¶ИМбёЯµЅ170ЎжЧуУТЈ¬ЖдЧоЦчТЄДїµДКЗ_____
ЈЁ4Ј©ЕР¶ПёГЦЖ±ё·ґУ¦ТСѕЅбКшµДЧојтµҐ·Ѕ·ЁКЗ_____Ј»
ЈЁ5Ј©ИфІъОпЦРУРЙЩБїОґ·ґУ¦µДBr2Ј¬ЧоєГУГ_____ПґµУіэИҐЈ»ЈЁМоХэИ·СЎПоЗ°µДЧЦДёЈ©
a Л® b СЗБтЛбЗвДЖ c µв»ЇДЖИЬТє d ТТґј
ЈЁ6Ј©·ґУ¦№эіМЦРУ¦УГАдЛ®АдИґЧ°ЦГDЈ¬ЖдЦчТЄДїµДКЗ_____Ј»µ«УЦІ»ДЬ№э¶ИАдИґЈЁИзУГ±щЛ®Ј©Ј¬ЖдФТтКЗ_____Ј®