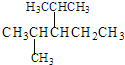题目内容
【题目】有机物A的相对分子质量不超过150,经测定可知A具有下列性质:
A所具有的性质 | 由此推出的A的组成或结构 |
①A能燃烧,燃烧产物只有CO2和H2O | |
②A与醇或羧酸在浓硫酸存在条件下发生反应均能生成有香味的物质 | |
③在一定条件下,A能发生分子内的脱水反应,生成物能使溴的CCl4溶液退色 | |
④0.1 mol A与足量NaHCO3溶液反应放出标准状况下4.48L气体 |
(1)填写表中空白_____________、__________________ 、_______________________。
(2)已知A分子中氧元素的质量分数为59.7%,则A的分子式为______________。
(3)假设A的结构式中不含碳支链,写出③中A所发生反应的化学方程式:__________________。
【答案】A中一定含有C、H,可能含有O A分子中含有-OH、-COOH A分子中含有两个-COOH C4H6O5 ![]()
【解析】
(1)由①中A燃烧产物只有CO2和H2O,根据原子守恒可知A中一定含有C、H,可能含有O。
答案为:A中一定含有C、H,可能含有O。
由②中A与醇或羧酸反应均能生成有香味的物质,可知A分子中含有—OH、—COOH。
答案为:A分子中含有—OH、—COOH。
由④中数据及反应R—COOH+HCO3—→CO2↑+H2О+R—COO-可知A分子中含有两个—COOH。
答案为:A分子中含有两个—COOH。
(2)设A的分子式为CxHyOz,由于16z ≤150×59.7%,即z ≤5.6,结合(1)中的分析,可知z=5,则A的相对分子质量为5×16/59.7%=134。因A分子中含有2个—COOH、1个—OH,故剩余基团的相对分子质量为134-90-17=27,剩余基团的组成为C2H3,所以A的分子式为C4H6O5。
答案为:C4H6O5。
(3)不含碳支链的A的结构简式为![]() ,发生分子内的脱水反应时生成不饱和二元酸,化学方程式为:
,发生分子内的脱水反应时生成不饱和二元酸,化学方程式为:![]() 。
。

【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大