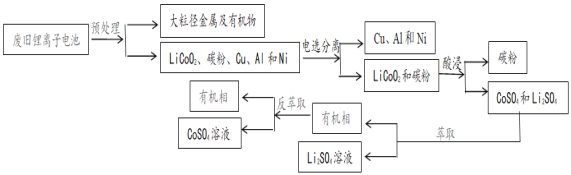
��Ŀ����
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣
��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д��ʵ������з�����Ӧ���ܻ�ѧ����ʽ��___���ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵���÷�Ӧ��__������ȡ����ȡ�����Ӧ��
��2��������ˮԡ��������ˮԡ������ˮԡ���ò���ͬ����������___���ҵ�������___��
��3����Ӧ����һ��ʱ����Թ�a�����ռ������л�����Ҫ��___��___��
��4�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л���__��Ҫ��ȥ�����ʣ������ڻ��Һ�м���___����д��ĸ����Ȼ��ͨ�����ɡ�
A.�Ȼ�����Һ B.�� C.̼��������Һ D.���Ȼ�̼
���𰸡�2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O ���� ʹ�Ҵ��������Ҵ����� ��ȴ��������ȩ������ ��ȩ �Ҵ� ���� C
2CH3CH2CHO+2H2O ���� ʹ�Ҵ��������Ҵ����� ��ȴ��������ȩ������ ��ȩ �Ҵ� ���� C
��������
���й������������ˮԡ���������£��������Ҵ���ͭ���£����ȷ���������ԭ��Ӧ������ȩ��ˮ���������е��Ҵ�����ȩ������ȴ�¿��ռ�����ȩ������ƿ�ռ���Ϊ�������ݴ˽��
��1��ͭ��������Ӧ���ɺ�ɫ������ͭ������ͭ���Ҵ�������Ӧ����ͭ����ȩ��ˮ���ù��̵��ܻ�ѧ����ʽΪ2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O��Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵���÷�Ӧ�Ƿ��ȷ�Ӧ���ų�����������ά�ַ�Ӧ���С�
2CH3CH2CHO+2H2O��Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵���÷�Ӧ�Ƿ��ȷ�Ӧ���ų�����������ά�ַ�Ӧ���С�
��Ϊ��2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O�����ȷ�Ӧ��
2CH3CH2CHO+2H2O�����ȷ�Ӧ��
��2����������ˮԡ���ò�ͬ��������ˮԡ��������ʹ�Ҵ�ƽ���������Ҵ�������������ˮԡ�������ǽ���ȩ��ȴ������
��Ϊ��ʹ�Ҵ��������Ҵ���������ȴ��������ȩ�����塣
��3���Ҵ�������Ϊ��ȩ��ͬʱ����ˮ���Ҵ�������ȫ��Ӧ��a����ȴ�ռ����л����У���ȩ���Ҵ���
��Ϊ����ȩ���Ҵ���
��4�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵����Һ�����ԣ�����Һ�к����������������ͨ�ԣ�4��ѡ���У�ֻ��̼�����ƿ��Ժ����ᷴӦ�����������ơ�ˮ�Ͷ�����̼��Ȼ����ͨ�����ɡ�
�������C ��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�����Ŀ����ҽ�����������鷨�����Ƿ���˪( As2O3)�ж����漰�ķ�Ӧ���£�
I��6Zn+As2O3+12HCl=6ZnCl2+2AsH3�����飩��+3H2O
��2AsH3=2As����ɫ�龵��+3H2
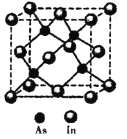
��1��д����Ļ�̬ԭ�Ӽ۵����Ų�ͼ______________��
��2������Ŀռ�ṹΪ_______����������ԭ���ӻ���ʽΪ________��
��3������ͬ��ͬϵ����������������±���
NH3 | PH3 | AsH3 | SbH3 | |
�۵�/�� | -77.8 | -133.5 | -116.3 | -88 |
�е�/�� | -34.5 | -87.5 | -62.4 | -18.4 |
��PH3��AsH3��SbH3�۷е��������ߵ�ԭ����_________��NH3���������ԭ����_______��
��4����һ����������I(As)>I(Se)�����ܵ�ԭ����_____________��
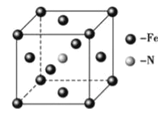
��5��������(In)�γɵĻ�����(X)���������Ĺ�����ܣ��㷺Ӧ���ڹ���ͨ���ü��������侧���ṹ��ͼ��ʾ�����仯ѧʽΪ______�������߳�a= 666.67pm�������ܶ�Ϊ_____g/cm3���߳�a����![]() ���Ƽ��㣬��NA=6.0��1023/mol����
���Ƽ��㣬��NA=6.0��1023/mol����
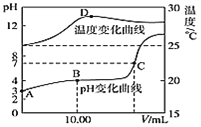
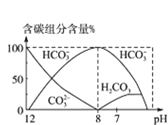
����Ŀ������ѪҺ�д��ڵ�ƽ�⣺H2CO3 ![]() HCO3-��ʹѪҺpH������7.35 ~ 7.45֮�䣬����ͻᷢ�����ж�����ж�����֪pH��
HCO3-��ʹѪҺpH������7.35 ~ 7.45֮�䣬����ͻᷢ�����ж�����ж�����֪pH��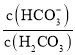 �仯��ϵ�����ʾ��������˵���д������
�仯��ϵ�����ʾ��������˵���д������
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7��ѪҺ�У�c(HCO3-)>c(H2CO3)
B.�������������巢�����ж�ʱ��c(H+)c(OH-)���
C.���巢�����ж�ʱ���ɾ�����עһ��Ũ�ȵ�NaHCO3��Һ�ⶾ
D.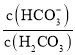 ��20.0ʱ��H2CO3�ĵ���̶�С��HCO3-��ˮ��̶�
��20.0ʱ��H2CO3�ĵ���̶�С��HCO3-��ˮ��̶�
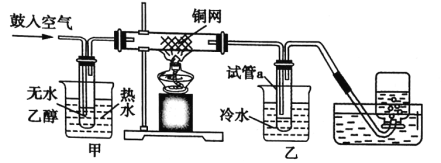
����Ŀ��ʵ����������������������Ҵ��Ʊ�1��2һ���������װ����ͼ��ʾ��

�й������б����£�
�Ҵ� | 1.2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g/cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�밴Ҫ��ش��������⣺
��1��д��Aװ���еĻ�ѧ��Ӧ����ʽ_____��
��2��װ��C��ʢ������������Һ����������_____
��3���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_____
��4���жϸ��Ʊ���Ӧ�Ѿ��������������_____��
��5����������������δ��Ӧ��Br2�������_____ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ��
a ˮ b ���������� c �⻯����Һ d �Ҵ�
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����_____�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____��