��Ŀ����
����Ŀ��������ѧ��ȤС�����������̽�������һ�飺Ϊ�о����ʲ�������Ũ����ķ�Ӧ��
��1����ȡ������̼�ظ֣�12.0g����30.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y���ټ�ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+ �� ��Ҫȷ�������Ƿ���Fe2+ �� Ӧѡ�������Լ�Ϊ��ѡ����ţ���
a��KSCN��Һ����ˮ b�����ۺ�KSCN��Һ c��Ũ��ˮ d������KMnO4��Һ
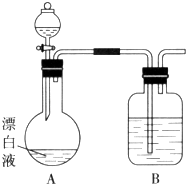
����ͬѧȡ672mL����״��������Yͨ��������ˮ�У�������Ӧ��SO2+Br2+2H2O=2HBr+H2SO4Ȼ���������BaCl2��Һ�����ʵ�������õ��������4.66g���ݴ���֪����Y��SO2���������Ϊ������С�����һλ����������ʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�л����ܺ�����H2��CO2���壮Ϊ�����������̽��ʵ��װ�ã�ͼ�мг�����ʡ�ԣ���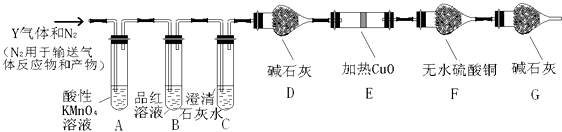
��д������CO2�Ļ�ѧ����ʽ ��
��װ��A���Լ��������� �� װ��G���Լ��������� ��
�ݼ���ȷ������Y�к���CO2��ʵ������ ��
���������Y�к���H2 �� Ԥ��ʵ������Ӧ�� ��
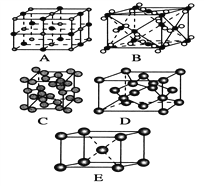
��2���ڶ��飺��������װ�ö�������������SO2�ĺ�����  ��KMnO4��Һ�е���ĩ��������״��ṹ��������
��KMnO4��Һ�е���ĩ��������״��ṹ��������
�ڸ�ʵ�����Ѿ�֪������������������aL/min������KMnO4��Һ�����bL����Ũ��Ϊcmol/L����������ͨ�뵽��ɫǡ����ȥ����ʱ5���ӣ���˴�ȡ�����Ŀ����ж���������Ϊg/L������֪KMnO4����ԭ�IJ���ͨ��ΪMn2+��
���𰸡�
��1��d��66.7%��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O����ȥ��������е�SO2����ֹ�����е�ˮ��������F��B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ�E�к�ɫ������ɫ��F����ˮ����ͭ�ɰ�ɫ����ɫ
CO2��+2SO2��+2H2O����ȥ��������е�SO2����ֹ�����е�ˮ��������F��B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ�E�к�ɫ������ɫ��F����ˮ����ͭ�ɰ�ɫ����ɫ
��2��������������Һ�ĽӴ���ʹ�����ֱ����գ�![]()
���������⣺��1������ҺΪFe3+��Fe2+���ӵĻ�������KSCN��Һ����ˮ�����ۺ�KSCN��Һ��Ũ��ˮ�����ܼ����������ӵĴ��ڣ��������Ӿ��л�ԭ�ԣ����������Һ����ɫ�����������ԣ������������������������·�Ӧ����ɫ�����Դ��ǣ�d����SO2+Br2+2H2O=2HBr+H2SO4 �� H2SO4+BaCl2=BaSO4��+2HCl���������ᱵ�Ͷ�������֮��Ĺ�ϵʽΪSO2����������BaSO4 ��
�������������ΪV��
SO2����������BaSO4 ��
22.4L 233g
V 4.66g
V=0.448l=448mL��
���Զ���������������= ![]() ��100%=66.7%�����Դ��ǣ�66.7%����̼�ظ��к���̼�����������£�̼�ܺ�Ũ���ᷴӦ���ɶ�����������̼��ˮ����Ӧ����ʽΪC+2H2SO4��Ũ��
��100%=66.7%�����Դ��ǣ�66.7%����̼�ظ��к���̼�����������£�̼�ܺ�Ũ���ᷴӦ���ɶ�����������̼��ˮ����Ӧ����ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O���۶�������Ͷ�����̼����ʹ����ʯ��ˮ����ǣ�������������л�ԭ�ԣ��������Ը�����ط���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+ �� װ��G���Լ��������Ƿ�ֹ�����е�ˮ��������F������װ��F���տ�����ˮ����Ӱ����飬���Դ��ǣ���ȥ��������е�SO2����ֹ�����е�ˮ��������F����ȷ������Y�к���CO2 �� Ӧ��ȫ�ų���������ĸ��ţ���B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ���˵������CO2 �� ���Դ��ǣ�B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ����������л�ԭ�ԣ��ܻ�ԭ�ԣ��ܻ�ԭ��ɫ������ͭ���ɺ�ɫ��ͭ���ʣ�ͬʱ����ˮ��ˮ��ʹ��ˮ����ͭ����ɫ�����Ǽ���ˮ��������Ӧ���������D������ͭ��죬E����ˮ����ͭ��������֤���������������Դ��ǣ�E�к�ɫ������ɫ��F����ˮ����ͭ�ɰ�ɫ����ɫ����2����KMnO4��Һ�е���ĩ��������״��ṹ����������������Һ�ĽӴ���ʹ�����ֱ����գ����Դ��ǣ�������������Һ�ĽӴ���ʹ�����ֱ����գ���ͨ��������a L/min��5min=5aL��KMnO4���ʵ���ΪbL��cmol/L=bcmol��
CO2��+2SO2��+2H2O���۶�������Ͷ�����̼����ʹ����ʯ��ˮ����ǣ�������������л�ԭ�ԣ��������Ը�����ط���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+ �� װ��G���Լ��������Ƿ�ֹ�����е�ˮ��������F������װ��F���տ�����ˮ����Ӱ����飬���Դ��ǣ���ȥ��������е�SO2����ֹ�����е�ˮ��������F����ȷ������Y�к���CO2 �� Ӧ��ȫ�ų���������ĸ��ţ���B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ���˵������CO2 �� ���Դ��ǣ�B��Ʒ����Һ����ɫ��C��ʯ��ˮ����ǣ����������л�ԭ�ԣ��ܻ�ԭ�ԣ��ܻ�ԭ��ɫ������ͭ���ɺ�ɫ��ͭ���ʣ�ͬʱ����ˮ��ˮ��ʹ��ˮ����ͭ����ɫ�����Ǽ���ˮ��������Ӧ���������D������ͭ��죬E����ˮ����ͭ��������֤���������������Դ��ǣ�E�к�ɫ������ɫ��F����ˮ����ͭ�ɰ�ɫ����ɫ����2����KMnO4��Һ�е���ĩ��������״��ṹ����������������Һ�ĽӴ���ʹ�����ֱ����գ����Դ��ǣ�������������Һ�ĽӴ���ʹ�����ֱ����գ���ͨ��������a L/min��5min=5aL��KMnO4���ʵ���ΪbL��cmol/L=bcmol��
5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+K2SO4
5 2
n��SO2�� bcmol
���� n��SO2��= ![]() bcmol������Ϊ
bcmol������Ϊ ![]() bcmol��64g/mol=160bcg���˴�ȡ�����Ŀ����ж���������Ϊ
bcmol��64g/mol=160bcg���˴�ȡ�����Ŀ����ж���������Ϊ ![]() g/L=
g/L= ![]() g/L�����Դ��ǣ�
g/L�����Դ��ǣ� ![]() ��
��