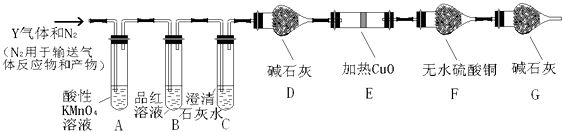
��Ŀ����
����Ŀ��ˮ������֮Դ���������ǵ�����������ء��ڻ�ѧʵ��Ϳ�ѧ�о��У�ˮҲ��һ�ֳ��õ��Լ���
��1��ˮ��������ԭ���ڻ�̬ʱ��������Ų�ʽΪ______��
��2��д����H2O���ӻ�Ϊ�ȵ��������________________����2������
��3���������ơ��⡢���ʯ���ɱ����Ȼ��ƾ���ľ���ͼ��δ��˳��������������Eͼ�ѻ���ʽ�Ŀռ�������Ϊ _________������ľ���������ͬ����________��������Ӧ�ı����д��
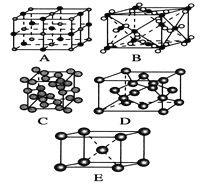
��4�������£��������أ�KO2�������������ṹ���侧���ṹ��NaCl����ͬ����ÿ�������к���___��K+��___��O2�� ��������K+ ����λ��Ϊ___ ��O2�� ����λ��Ϊ______��
��5��60 g ���ʯ�еĹ��ۼ���Ϊ_________����60g SiO2�����еĹ��ۼ���Ϊ_______����
���𰸡� 1s22s22p4 H2S NH2- 68% BC 4 4 6 6 10NA 4NA
��������(1)��ԭ�Ӻ��������8�����ӣ���ԭ�ӵĻ�̬��������Ų�Ϊ��1s22s22p4���ʴ�Ϊ��1s22s22p4��
(2)ԭ�Ӹ�����ȡ��۵�������ȵ���Ϊ�ȵ����壬��ˮ��Ϊ�ȵ������������3ԭ������������Ϊ8�ķ��ӻ����ӣ����������У�H2S��NH2-���ʴ�Ϊ��H2S��NH2-��
(3)���ݾ����ṹͼ��AΪ�Ȼ��ƣ�BΪ�ɱ���CΪ�⣬DΪ���ʯ��EΪ�ơ�E(![]() )ͼΪ���������ѻ����ռ�������Ϊ68%�������ڷ��Ӿ��壬�ɱ��͵����ڷ��Ӿ��壬�������ľ���������ͬ����BC���ʴ�Ϊ��68%��BC��
)ͼΪ���������ѻ����ռ�������Ϊ68%�������ڷ��Ӿ��壬�ɱ��͵����ڷ��Ӿ��壬�������ľ���������ͬ����BC���ʴ�Ϊ��68%��BC��
(4)�����£���������(KO2)�����������ṹ���侧���ṹ��NaCl����ͬ���Ȼ��Ƶľ����ṹΪ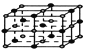 ����ÿ�������к���K+��ĿΪ8��
����ÿ�������к���K+��ĿΪ8��![]() +12��
+12��![]() =4������O2����ĿΪ6��
=4������O2����ĿΪ6��![]() +1=4��������ÿ��K+��Χ��������������O2����6������λ��Ϊ6��ͬ��O2�� ����λ��Ϊ6���ʴ�Ϊ��4��4��6��6��
+1=4��������ÿ��K+��Χ��������������O2����6������λ��Ϊ6��ͬ��O2�� ����λ��Ϊ6���ʴ�Ϊ��4��4��6��6��
(5)60 g ���ʯ�к���Cԭ�ӵ����ʵ���Ϊ![]() =5mol��ÿ��̼ԭ������Χ4��̼�γɹ��ۼ���ÿ�����ۼ���2��̼ԭ�ӹ��ã����ÿ��̼ԭ�Ӻ���2�����ۼ������ۼ���Ϊ10NA����60g SiO2�����ʵ���Ϊ1mol������1mol��ԭ�ӣ�ÿ����ԭ������Χ4����ԭ���γɹ��ۼ������ۼ���Ϊ4NA�����ʴ�Ϊ��10NA��4NA��
=5mol��ÿ��̼ԭ������Χ4��̼�γɹ��ۼ���ÿ�����ۼ���2��̼ԭ�ӹ��ã����ÿ��̼ԭ�Ӻ���2�����ۼ������ۼ���Ϊ10NA����60g SiO2�����ʵ���Ϊ1mol������1mol��ԭ�ӣ�ÿ����ԭ������Χ4����ԭ���γɹ��ۼ������ۼ���Ϊ4NA�����ʴ�Ϊ��10NA��4NA��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�