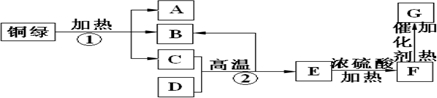
题目内容
下列叙述正确的是( )
| A、加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B、碳酸氢钠溶液中离子浓度的大小关系c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) |
| C、碳酸钠溶液中离子浓度的关系2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
考点:离子浓度大小的比较,离子共存问题
专题:离子反应专题,盐类的水解专题
分析:A.加入铝粉能产生氢气的溶液可能呈强酸性或强碱性,能反应的离子不能存在;
B.碳酸氢钠中钠离子不水解,碳酸氢根离子水解程度大于电离程度,但程度都较小,溶液呈碱性;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.二者反应生成碳酸钙和次氯酸.
B.碳酸氢钠中钠离子不水解,碳酸氢根离子水解程度大于电离程度,但程度都较小,溶液呈碱性;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.二者反应生成碳酸钙和次氯酸.
解答:
解:A.加入铝粉能产生氢气的溶液可能呈强酸性或强碱性,在强酸性条件下,亚铁离子和硝酸根离子发生氧化还原反应而不能共存,在强碱性条件下,氢氧根离子和亚铁离子生成沉淀、和铵根离子生成一水合氨,所以不能大量共存,故A错误;
B.碳酸氢钠中钠离子不水解,碳酸氢根离子水解程度大于电离程度,但程度都较小,溶液呈碱性,水和碳酸氢根离子电离都生成氢离子,只有碳酸氢根离子电离生成碳酸根离子,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.二者反应生成碳酸钙和次氯酸,离子方程式为Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故D错误;
故选B.
B.碳酸氢钠中钠离子不水解,碳酸氢根离子水解程度大于电离程度,但程度都较小,溶液呈碱性,水和碳酸氢根离子电离都生成氢离子,只有碳酸氢根离子电离生成碳酸根离子,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.二者反应生成碳酸钙和次氯酸,离子方程式为Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故D错误;
故选B.
点评:本题考查了离子共存、盐类水解、离子方程式的书写等知识点,根据溶质的性质、离子方程式书写特点再结合守恒思想分析解答,注意A中酸性条件下硝酸根离子的强氧化性,为易错点.

练习册系列答案
相关题目
能证明乙烯里含有一个碳碳双键的事实是( )
| A、乙烯能使酸性KMnO4溶液褪色 |
| B、乙烯分子里碳、氢原子个数比为1:2 |
| C、乙烯完全燃烧生成的CO2和H2O的物质的量相等 |
| D、乙烯容易与溴水发生反应,且1 mol乙烯完全加成消耗1 mol溴单质 |
(双项)在标准状况下,将2.24L NH3与4.48L HCl气体充入密闭容器内混合.已知:NH3+HCl═NH4Cl.下列说法正确的是( )
| A、反应中有0.5NA个共价键断裂 |
| B、反应中有0.1NA个离子键形成 |
| C、混合后,容器内物质含有0.5 NA个化学键 |
| D、混合前气体中含有0.5NA个共价键 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都容易发生取代反应 |
| B、苯不能被KMnO4氧化 |
| C、苯只能在特殊条件下发生加成反应 |
| D、都能在空气中燃烧 |
X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:①元素对应的原子半径大小为:X<Z<Y<M<W;②Y是组成有机物的必要元素 ③Z与X可形成两种常见的共价化台物,与W可形成两种常见的离子化台物;④M的电子层数与最外层电子数相等.下列说法不正确的是( )
| A、Z、W、M形成的简单离子,其半径大小关系为Z>W>M |
| B、M的最高价氧化物对应的水化物与Y、W两元素最高价氧化物对应的水化物均能反应 |
| C、工业上可用电解熔融的W的氯化物的方法制取W单质 |
| D、Y、Z元素形成的简单氢化物的稳定性:Z>Y |
下列化学用语表达正确的是( )
| A、乙酸的结构简式:CH3-COOH |
B、丙烷分子的比例模型: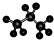 |
C、Ar原子的结构示意图: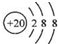 |
D、过氧化氢的电子式: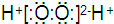 |