题目内容
3.有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示.请回答: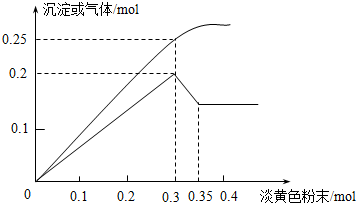
(1)淡黄色粉末为过氧化钠(填名称),溶液中肯定没有Fe3+、Cu2+离子.
(2)当加入0.3mol淡黄色粉末时,生成气体成分是NH3,O2,物质的量之比是(假设生成的气体都能完全逸出)2:3.
(3)沉淀部分减少时的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)溶液中存在的各溶质阳离子及其物质的量分别是Mg2+:0.1mol;
NH4+:0.1mol;
Al3+:0.1mol.
分析 根据实验现象判断Fe3+、Cu2+、NH4+是否存在,根据图象判断Mg2+、Al3+是否存在,加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,在0.3-0.35mol这一段内,共溶解氢氧化铝沉淀0.1mol,则根据Al3+~Al(OH)3~[Al(OH)4]-,所以铝离子的物质的量是0.1mol,在0~0.3mol过氧化钠这一段,生成沉淀量最大,是氢氧化镁和氢氧化铝的混合物,所以含有氢氧化镁也是0.1mol,根据Mg2+~Mg(OH)2,所以镁离子的物质的量是0.1mol,根据气体的量,当加入0.3mol过氧化钠时,理论上会产生0.15mol的氧气,此时生成气体共0.25mol,所以会生成0.1mol的氨气,据此判断即可.
解答 解:(1)淡黄色粉末是过氧化钠,是含有钠离子和过氧根离子的离子化合物,由于溶液透明无色,那么一定不存在Fe3+、Cu2+,因为两者分别为黄绿色和蓝色,故答案为:过氧化钠;Fe3+、Cu2+;
(2)加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,在0.3-0.35mol这一段内,共溶解氢氧化铝沉淀0.1mol,则根据Al3+~Al(OH)3~[Al(OH)4]-,所以铝离子的物质的量是0.1mol,在0~0.3mol过氧化钠这一段,生成沉淀量最大,是氢氧化镁和氢氧化铝的混合物,所以含有氢氧化镁也是0.1mol,根据Mg2+~Mg(OH)2,所以镁离子的物质的量是0.1mol,根据气体的量,当加入0.3mol过氧化钠时,理论上会产生0.15mol的氧气,此时生成气体共0.25mol,所以会生成0.1mol的氨气,根据NH4+~NH3↑,铵根离子的物质的量为:0.1mol,故答案为:NH3,O2;2:3;
(3)氢氧化铝为两性氢氧化物,能溶于氢氧化钠溶液,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)由(2)可知溶液中存在:Mg2+:0.1mol;NH4+:0.1mol;Al3+:0.1mol,故答案为:Mg2+:0.1mol;NH4+:0.1mol;Al3+:0.1mol.
点评 本题考查的是常见阳离子的检验,注意各个离子的性质,结合图象的方式考查增加了难度,本题综合性很强,难度很大.

| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
| A. | 硫酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
| A. | 通入足量溴的四氯化碳溶液 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 在一定条件下通入氢气 |
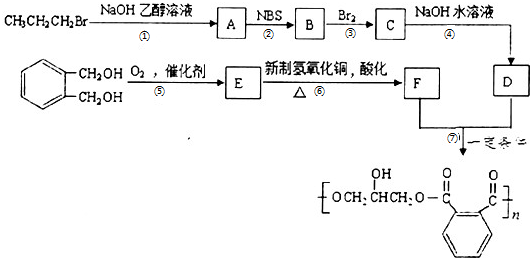
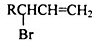
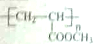 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.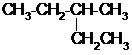 的系统命名为2-甲基戊烷;.
的系统命名为2-甲基戊烷;. ③白磷 ④18O ⑤
③白磷 ④18O ⑤