题目内容
5.在一密闭容器内盛有溴化氢气体,在一定温度下建立如下化学平衡2HBr?H2+Br2-Q,如果升高温度:(1)正反应速率将增大,逆反应速率将增大,原因是升高温度,单位体积内的活化百分数增大,则活化分子增多.
(2)化学平衡将向正方向移动,原因是升高温度化学平衡向着吸热方向进行,又该反应2HBr?H2+Br2-Q为吸热反应.
(3)混合气颜色将加深,原因是升高温度化学平衡向着吸热方向进行,即正向移动,溴单质浓度增大.
分析 (1)升高温度,正逆反应速率都增大;
(2)升高温度化学平衡向着吸热方向进行,又该反应2HBr?H2+Br2-Q为吸热反应,所以平衡正向移动;
(3)升高温度化学平衡向着吸热方向进行即正向移动,根据混合气颜色与溴单质浓度成正比判断;
解答 解:(1)升高温度,单位体积内的活化百分数增大,则活化分子增多,所以正逆反应速率都增大,
故答案为:增大;增大;升高温度,单位体积内的活化百分数增大,则活化分子增多;
(2)升高温度化学平衡向着吸热方向进行,又该反应2HBr?H2+Br2-Q为吸热反应,所以平衡正向移动,
故答案为:正;升高温度化学平衡向着吸热方向进行,又该反应2HBr?H2+Br2-Q为吸热反应;
(3)升高温度化学平衡向着吸热方向进行即正向移动,所以溴单质浓度增大,颜色加深,
故答案为:加深;升高温度化学平衡向着吸热方向进行,即正向移动,溴单质浓度增大;
点评 本题考查影响化学平衡移动的因素,难度不大.要熟练掌握勒夏特列原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于有机物的说法中,正确的是 ( )
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 乙烯和苯都能使溴水褪色 | |
| C. | 利用点燃的方法可以鉴别甲烷和乙烯 | |
| D. | 油脂、葡萄糖、蛋白质都可以发生水解反应 |
17.下列叙述及解释正确的是( )
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
18.下列物质混合后,能发生离子反应的是( )
| A. | 硫酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
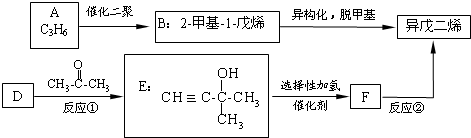
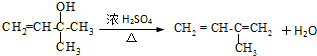 .
. .
.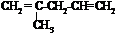 外,还有
外,还有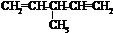 、
、 (填结构简式,已知
(填结构简式,已知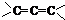 不稳定).
不稳定).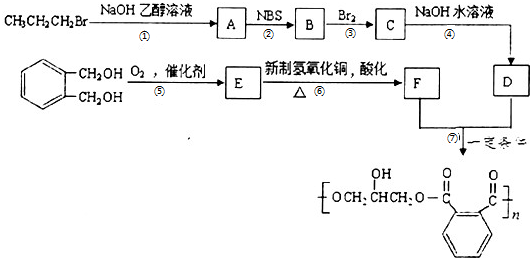
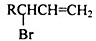
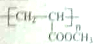 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.