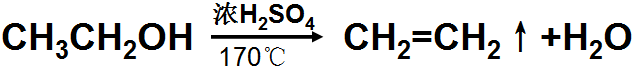题目内容
9.某温度下,水的离子积常数为1×10-12,在该温度下,0.1mol/L的HCl溶液pH=1,0.1mol/L的NaOH溶液pH=11,若将两者按体积比V(HCl):V(NaOH)=9:11混合,则混合液的pH值约为10.分析 0.1mol/L的HCl溶液中c(H+)=0.1mol/L,根据pH=-lgc(H+)计算出该溶液的pH;0.1mol/L的氢氧化钠溶液中c(OH-)=0.1mol/L,c(H+)=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,再根据pH=-lgc(H+)计算出该溶液的pH;若将两者按体积比V(HCl):V(NaOH)=9:11混合,两溶液浓度相等,则混合液中氢氧根离子过量,溶液显示碱性,先计算出混合液中氢氧根离子浓度,再根据该温度下水的离子积计算出混合液中氢离子浓度,最后计算出混合液的pH.
解答 解:某温度下Kw=c(H+)×c(OH-)=1×10-12,0.1mol/L的HCl溶液中c(H+)=0.1mol/L,该盐酸的pH=-lgc(H+)=1;
0.1mol/L的氢氧化钠溶液中c(OH-)=0.1mol/L,c(H+)=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,该温度下,在0.1mol/L的氢氧化钠溶液中c(H+)=10-11mol/L,pH=-lgc(H+)=11;
若将两者按体积比V(HCl):V(NaOH)=9:11混合,由于二者浓度相同,则混合液中氢氧化钠过量,混合液显示碱性,溶液中氢氧根离子浓度为:c(OH-)=$\frac{(11-9)0.1}{11+9}$mol/L=0.01mol/L,该温度下c(OH-)=0.01mol/L的溶液中c(H+)=$\frac{1{0}^{-12}}{0.01}$=10-10mol/L,则混合液的pH值约为
:pH=-lgc(H+)=10,
故答案为:1;11;10.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 乙烯和苯都能使溴水褪色 | |
| C. | 利用点燃的方法可以鉴别甲烷和乙烯 | |
| D. | 油脂、葡萄糖、蛋白质都可以发生水解反应 |
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
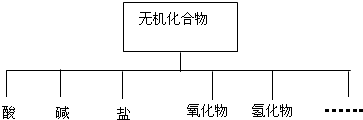
(1)如图所示的物质分类方法名称是树状分类法.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧SO3 | ⑨NH3 |
| A. | 硫酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
| A. | ①②③ | B. | ②④⑤ | C. | 仅①③ | D. | ①②③④⑤ |
 实验室用如图所示装置制取乙烯.
实验室用如图所示装置制取乙烯.