题目内容
【题目】科学家正在研究温室气体CH4、CO2的转化和利用。
(1)在Ni基催化剂的作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni外围价电子中有_________对成对电子。
②CH4、CO2、H2分子中有孤对电子的是_________.
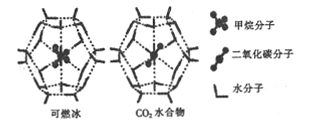
(2)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数如下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/mm | 分子与H2O的结合能(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
①CO2水合物分子间存在的两种作用力是___________.
②为开采深海海底的“可燃冰”,科学家已经证明可用CO2置换CH4。已知上图中笼状结构的空腔直径为xnm,根据上述图表,从物质的结构与性质的角度分析:x_____0.512;y_______16.40。(填“>”“<"或“=”)
③写出CH4的一种等电子体: __________;SiO2与CO2是否互为等电子体?_________(填“是”或“不是”),理由是________.
【答案】 4 CO2 范德华力、氢键 > > SiH4 不是 SiO2不是分子,两者化学键类型不同
【解析】(1)①Ni为28号元素,基态Ni原子的电子排布式为![]() ,有4对成对电子;②CH4中C最外层有4个电子,有4对共用电子对,因而没有孤对电子;H2中H最外层有1个电子,有1对共用电子对,因而没有孤对电子; CO2中O最外层有6个电子,有2对共用电子对,因而O含有孤对电子;故答案为: ① 4 ② CO2
,有4对成对电子;②CH4中C最外层有4个电子,有4对共用电子对,因而没有孤对电子;H2中H最外层有1个电子,有1对共用电子对,因而没有孤对电子; CO2中O最外层有6个电子,有2对共用电子对,因而O含有孤对电子;故答案为: ① 4 ② CO2
(2)①可燃冰中存在水分子,水分子间存在范德华力和氢键;②由表格可以知道:二氧化碳的分子直径小于笼状结构的空腔直径,即x>0.512,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即y >16.40; ③等电子体是指价电子数和原子数相同,并且具有相同结构的微粒,可以是分子、离子或原子团,SiH4是CH4的一种等电子体;SiO2是原子晶体,CO2是分子晶体,二者不能互为等电子体;故答案为:①范德华力、氢键 ②> 、 > ③SiH4 、 不是 、 SiO2不是分子,两者化学键类型不同

 阅读快车系列答案
阅读快车系列答案【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是

选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D