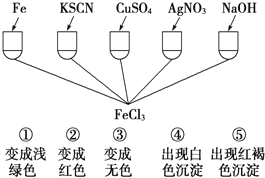
题目内容
【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是
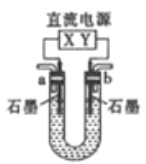
选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D
【答案】C
【解析】A.电解Na2SO4溶液时,阳极上是氢氧根离子发生失电子的氧化反应,即a管中氢氧根放电,酸性增强,酸遇酚酞不变色,即a管中呈无色,A错误;B.电解硝酸银溶液时,阴极上是银离子发生得电子的还原反应,即b管中电极反应是析出金属银的反应,故B错误;C. 电解CuCl2溶液时,阳极上是氯离子发生失电子的氧化反应,即b管中氯离子放电,产生氯气,C正确;D.电解NaOH溶液时,阴极上是氢离子放电,阳极上是氢氧根离子放电,实际上电解的是水,导致NaOH溶液的浓度增大,碱性增强,PH升高,D错误。答案选C.

【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
T℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)上述反应为____(填“放热”或“吸热”)反应,升高温度,平衡向______ (填“正反应”或“逆反应”) 方向移动。
(2)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(B)发生上述应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=______mol·L-1·min-l。
②该温度下反应的平衡常数K=______.
(3)生产水煤气的过程如下:
①C(s)+CO2(g) ![]() 2CO(g)ΔH1
2CO(g)ΔH1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
③反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
【题目】科学家正在研究温室气体CH4、CO2的转化和利用。
(1)在Ni基催化剂的作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni外围价电子中有_________对成对电子。
②CH4、CO2、H2分子中有孤对电子的是_________.
(2)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数如下表。CH4与H2O形成的水合物俗称“可燃冰”。
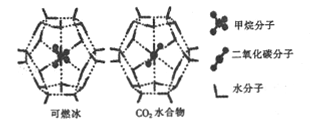
参数 分子 | 分子直径/mm | 分子与H2O的结合能(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
①CO2水合物分子间存在的两种作用力是___________.
②为开采深海海底的“可燃冰”,科学家已经证明可用CO2置换CH4。已知上图中笼状结构的空腔直径为xnm,根据上述图表,从物质的结构与性质的角度分析:x_____0.512;y_______16.40。(填“>”“<"或“=”)
③写出CH4的一种等电子体: __________;SiO2与CO2是否互为等电子体?_________(填“是”或“不是”),理由是________.
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
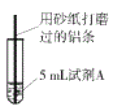
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。

①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。