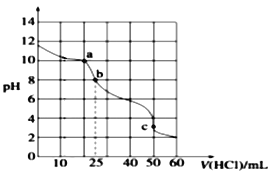
��Ŀ����
����Ŀ������������ȷ����( )
�� ���д���AlO2-����Һ�У�NH4+��NO3-��H+��Cl-���Դ�������
�� 0.1 molL-1��AlCl3��Һ�У�Na+��K+��SO42-��HCO3-���Դ�������
�� ��AlCl3��Һ�м��������ϡ��ˮ��������Ӧ��Al3++4NH3H2O=AlO2-+4NH4++2H2O
�� ���������ܷų�H2����Һ�У�Ca2+��Fe2+��Cl-��NO3-һ���ܹ���������
�� ��NaOH��Һ��ȥ�������������Ĥ��Al2O3+2OH-=2AlO2-+H2O
�� �������ȷ�Ӧԭ�����ܷ�����Ӧ2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
�� ��������Һ�м������Ba(OH)2��Һ��������Ӧ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O
�� �����£��������ڹ���Ũ���ᣬҲ�����ڹ���NaOH��Һ
A. �ݢ� B. �ڢۢ� C. �ܢݢ� D. �ڢߢ�
���𰸡�A
��������
AlO2-ֻ�ܴ����ڼ�����Һ�У�����H+���Է�Ӧ��Al3+��HCO3-����˫ˮ�ⷴӦ�������������������Ͷ�����̼���壻AlCl3��Һ�м��������ϡ��ˮ�������������������Ȼ�������������ܷų�H2����Һ�����Ի�ǿ������������������������Һ��Ӧ����ƫ�����ƣ�þ�Ļ����Դ�������Al��MgO����Ӧ����������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ�����������£�����Ũ�����жۻ���
AlO2-ֻ�ܴ����ڼ�����Һ�У�����H+���Է�Ӧ�����д���AlO2-����Һ�������ܺ��д�����H+������������Al3+��HCO3-����˫ˮ�ⷴӦ�������������������Ͷ�����̼���壬AlCl3��Һ�в��ܺ��д�����HCO3-����������AlCl3��Һ�м��������ϡ��ˮ�������������������Ȼ������Ӧ���ӷ���ʽ��Al3++3NH3H2O=Al(OH)3![]() +3NH4+���������������������ܷų�H2����Һ�����Ի�ǿ���ԣ��������ᷴӦ���ܷų����������������£�Fe2+��NO3-����������ԭ��Ӧ��ǿ���������£��������Ӳ��ܴ������档��������������������������Һ��Ӧ����ƫ�����ƣ���Ӧ���ӷ���ʽ��Al2O3+2OH-=2AlO2-+H2O��������ȷ��þ�Ļ����Դ�������Al��MgO����Ӧ��������������������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ��������Ӧ���ӷ���ʽ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O��������ȷ�������£�����Ũ�����жۻ���������Ũ�������ʢ��������ѡA��
+3NH4+���������������������ܷų�H2����Һ�����Ի�ǿ���ԣ��������ᷴӦ���ܷų����������������£�Fe2+��NO3-����������ԭ��Ӧ��ǿ���������£��������Ӳ��ܴ������档��������������������������Һ��Ӧ����ƫ�����ƣ���Ӧ���ӷ���ʽ��Al2O3+2OH-=2AlO2-+H2O��������ȷ��þ�Ļ����Դ�������Al��MgO����Ӧ��������������������Һ�м������Ba(OH)2��Һ����ƫ����غ����ᱵ��������Ӧ���ӷ���ʽ��2SO42-+2Ba2++Al3++4OH-=2BaSO4��+AlO2-+2H2O��������ȷ�������£�����Ũ�����жۻ���������Ũ�������ʢ��������ѡA��

����Ŀ����ѧ�������о���������CH4��CO2��ת�������á�
��1����Ni��������������,CH4��CO2��Ӧ�ɻ�û���ԭ��CO��H2��
�ٻ�̬Ni��Χ�۵�������_________�ԳɶԵ��ӡ�
��CH4��CO2��H2�������й¶Ե��ӵ���_________.
��2��һ��������,CH4��CO2������H2O�γ���״�ṹ(��ͼ��ʾ)��ˮ���ᄃ��,����ز������±���CH4��H2O�γɵ�ˮ�����׳�����ȼ������
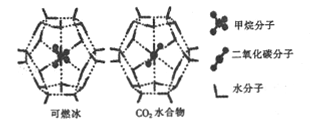
���� ���� | ����ֱ��/mm | ������H2O�Ľ����(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
��CO2ˮ������Ӽ���ڵ�������������___________.
��Ϊ�������������ȼ����,��ѧ���Ѿ�֤������CO2�û�CH4����֪��ͼ����״�ṹ�Ŀ�ǻֱ��Ϊxnm,��������ͼ��,�����ʵĽṹ�����ʵĽǶȷ���:x_____0.512;y_______16.40��(����>����<"����=��)
��д��CH4��һ�ֵȵ�����: __________;SiO2��CO2�Ƿ�Ϊ�ȵ�����?_________(������������������),������________.