题目内容
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 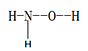 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【答案】N、O 羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水 N 11 2NO(g)+2 CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol
【解析】
(1)①羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水。
②在羟胺的组成的元素中,处于同一周期元素是N和O,N原子失去3个电子后价电子排布式为2s2,O原子失去3个电子后价电子排布式为2s22p1。
(2)根据吡啶![]() 的结构简式可知,每个吡啶分子含有11个σ键。
的结构简式可知,每个吡啶分子含有11个σ键。
(3)根据盖斯定律计算。
(1)①羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水,故答案为:N、O ;羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水。
②在羟胺的组成的元素中,处于同一周期元素是N和O,N原子失去3个电子后价电子排布式为2s2,2s处于全充满状态,较稳定,O原子失去3个电子后价电子排布式为2s22p1,故第四电离能(I4)较大的是N,故答案为:N。
(2)根据吡啶![]() 的结构简式可知,每个吡啶分子含有11个σ键,故l mol吡啶中含有
的结构简式可知,每个吡啶分子含有11个σ键,故l mol吡啶中含有![]() 键的物质的量为11 mol,故答案为:11。
键的物质的量为11 mol,故答案为:11。
(3)NO与CO反应生成无污染物气体为CO2和N2,反应的方程式为2NO+2CO![]() N2+2CO2,
N2+2CO2,
根据表中数据可知,反应①NO2(g) + CO (g) ![]() CO2(g) + NO (g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol=-234 kJ/mol,已知②N2(g)+O2(g)
CO2(g) + NO (g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol=-234 kJ/mol,已知②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol ,③2NO(g) +O2(g)
2NO(g) ΔH=+179.5 kJ/mol ,③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol 根据盖斯定律可知,①×2+ ③-②得2NO(g)+2 CO (g)
2NO2(g) ΔH=-112.3 kJ/mol 根据盖斯定律可知,①×2+ ③-②得2NO(g)+2 CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol,故答案为:2NO(g)+2CO (g)
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol,故答案为:2NO(g)+2CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol。
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。