题目内容
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
【答案】ds 乙炔 正四面体型 极性 > > 3d104s1 ![]() Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )
Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )
【解析】
根据元素周期表位置分析①为H ②为Be ③为C④Mg⑤Al⑥P⑦S⑧Cl⑨Cu⑩Zn。
(1)表中⑨号Cu属于ds区元素,故答案为:ds。
(2)2个C和2个H形成的直线型分子为C2H2,名称为乙炔,③和⑧形成的一种常见溶剂为CCl4,CCl4空间构型为正四面体型,故答案为:乙炔;正四面体型。
(3)元素①和⑥形成的最简单分子为PH3,PH3分子空间构型为三角锥形,正负电荷中心不重合,为极性分子,故答案为:极性。
(4)同一周期从左往右,第一电离能有逐渐增大的趋势,P的外围电子排布为3s23p3,p轨道处于半充满状态,第一电离能大于S的;同一主族,从上往下,元素电负性逐渐减小,元素②的电负性大于元素④的电负性,故答案为:>;>。
(5)⑨为Cu,原子序数为29,基态原子核外价电子排布式是3d104s1,故答案为:3d104s1。
(6)元素⑧和④形成的化合物为MgCl2,电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(7)元素⑩的氢氧化物为Zn(OH)2,仿Al(OH)3与NaOH溶液反应的化学方程式,Zn(OH)2与NaOH溶液反应的化学方程式:Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] ),故答案为:Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 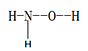 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。