题目内容
【题目】实验室制取氯气的化学方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)反应物HCl中氯元素的化合价为___。
(2)在该氧化还原反应中,MnO2做___剂,锰元素被___,而HCl在反应中表现的性质包括___和___。
(3)若有6molCl2生成时,反应中转移___mol电子。
(4)写出该反应的离子方程式___,用双线桥法标出电子转移的方向和数目:___。
【答案】-1 氧化 还原 酸性 还原性 12 4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O 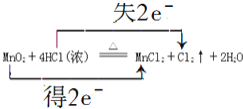
【解析】
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O中Mn元素的化合价降低,Cl元素的化合价升高,该反应转移2e,盐酸作酸及还原剂作用,以此来解答。
Cl2↑+MnCl2+2H2O中Mn元素的化合价降低,Cl元素的化合价升高,该反应转移2e,盐酸作酸及还原剂作用,以此来解答。
(1)反应物HCl中H为+1价,氯元素的化合价为1价;
(2)在该氧化还原反应中,Mn元素的化合价降低,MnO2做氧化剂,锰元素被还原.而HCl在反应中表现的性质包括酸性和还原性;
(3)若有6molCl2生成时,反应中转移6mol×2×(10)=12mol电子;
(4)该反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;该反应中转移电子数为2e,用双线桥法标出电子转移方向和数目为
Mn2++Cl2↑+2H2O;该反应中转移电子数为2e,用双线桥法标出电子转移方向和数目为 。
。

【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 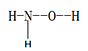 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式_________,当该反应以表中数据反应完全时转移电子数为_______NA;
(2)V1=________ mL;
(3)根据上表中的实验①、②数据,可以得到的结论是________。
(4)探究温度对化学反应速率的影响,应选择________(填实验编号);
(5)该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。

该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①小组同学提出的假设是_________。
②若该小组同学提出的假设成立,应观察到_______________________现象。