题目内容
20.X、Y、Z、W是原子序数依次增大的前20号元素,X、Y同周期,Y、Z同主族,X原子的最外层电子数为内层电子数的2倍,Y是地壳中含量最多的元素,W为金属元素,且原子中无成单电子,下列叙述不正确的是( )| A. | Z的离子半径比W的离子半径小 | |
| B. | 第一电离能:X<Y | |
| C. | Y的氢化物的沸点比Z的氢化物沸点高 | |
| D. | 室温时,WXY3在纯水存在沉淀溶解平衡 |
分析 X、Y、Z、W是原子序数依次增大的前20号元素,X原子的最外层电子数为内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y是地壳中含量最多的元素,则Y为O元素;Y、Z同主族,则Z为S元素;W为金属元素,原子序数大于硫,处于第四周期,且原子中无成单电子,最外层电子数为2,故W为Ca,据此解答.
解答 解:X、Y、Z、W是原子序数依次增大的前20号元素,X原子的最外层电子数为内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y是地壳中含量最多的元素,则Y为O元素;Y、Z同主族,则Z为S元素;W为金属元素,原子序数大于硫,处于第四周期,且原子中无成单电子,最外层电子数为2,故W为Ca,
A.Z的离子、W的离子分别为S2-、Ca2+,二者电子层结构相同,核电荷数越大,离子半径越小,故离子半径:S2->Ca2+,故A错误;
B.同周期随原子序数增大,第一电离能呈增大趋势,故第一电离能C>O,故B正确;
C.Y的氢化物、Z的氢化物分别为H2O、H2S,水分子之间存在氢键,沸点高于硫化氢,故C正确;
D.室温时,CaCO3在纯水存在沉淀溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq),故D正确,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意同周期中元素第一电离能异常情况.

练习册系列答案
相关题目
10.以下两反应达到平衡后分别加入少量H${\;}_{2}^{18}$O,重新达平衡时,含18O的物质分别是( )
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
| A. | 2种 3种 | B. | 3种 2种 | C. | 3种 4种 | D. | 2种 2种 |
8.关于元素周期表的叙述中,不正确的是( )
| A. | 俄国化学家门捷列夫编制了第一个元素周期表 | |
| B. | 元素周期律是由原子核外电子排布的周期性变化引起的 | |
| C. | 在元素周期表的过渡元素区域中寻找制催化剂的元素 | |
| D. | 元素周期表中最右上角元素的非金属性最强 |
5.下列叙述中正确的是( )
| A. | 实验室欲配制480mL0.10mol•L-1的CuSO4溶液,可用12.0g胆矾及相应容器配制 | |
| B. | 将适量FeCl3饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| C. | 实验室中从海带里提取碘的过程是:灼烧→溶解→过滤→萃取 | |
| D. | 用分液漏斗、烧杯、铁架台(带铁圈)、饱和Na2CO3溶液可除去乙酸乙酯中的乙酸 |
12.制备下列物质的工业生产流程合理是( )
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{20}}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{20}}$CH3CH2OH$→_{△}^{Cu/O_{2}}$CH3CHO$→_{△}^{新制银氨溶液}$CH3COOH |
9.下列说法不正确的是( )
| A. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| B. | 乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素 | |
| C. | 淀粉与稀硫酸混合加热一段时间后,滴加碘水溶液变蓝,说明淀粉没有水解 | |
| D. | Na2SO4•10H2O失水时吸热,结晶时放热,因而该晶体可作储热材料实现化学能与热能相互转化 |
10.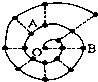 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
 如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.
如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.