题目内容
8.关于元素周期表的叙述中,不正确的是( )| A. | 俄国化学家门捷列夫编制了第一个元素周期表 | |
| B. | 元素周期律是由原子核外电子排布的周期性变化引起的 | |
| C. | 在元素周期表的过渡元素区域中寻找制催化剂的元素 | |
| D. | 元素周期表中最右上角元素的非金属性最强 |
分析 A、俄国化学家门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出第一张元素周期表;
B、元素的原子核外电子排布的周期性变化引起元素性质的周期表变化;
C、在过渡元素中寻找制造催化剂元素及制造高温、耐腐蚀合金材料;
D、最右上角元素是氦,氦为稀有气体.
解答 解:A、俄国化学家门捷列夫发现了元素周期律,并编制出第一张元素周期表,故A正确;
B、元素的原子核外电子排布的周期性变化引起元素性质的周期表变化,即为元素周期律的实质,故B正确;
C、优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素,故C正确;
D、最右上角元素是氦,氦为稀有气体,性质最稳当,故D错误;
故选D.
点评 本题考查元素周期表与元素周期律的应用,题目较为简单,注意基础知识的积累.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.下列方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 硫化钠溶液呈碱性的原因:S2-+2H2O=H2S+2OH- | |
| C. | 向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ | |
| D. | 氧化亚铁溶于稀硝酸中:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
13.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A. | 7:1 | B. | 7:2 | C. | 7:3 | D. | 7:4 |
20.X、Y、Z、W是原子序数依次增大的前20号元素,X、Y同周期,Y、Z同主族,X原子的最外层电子数为内层电子数的2倍,Y是地壳中含量最多的元素,W为金属元素,且原子中无成单电子,下列叙述不正确的是( )
| A. | Z的离子半径比W的离子半径小 | |
| B. | 第一电离能:X<Y | |
| C. | Y的氢化物的沸点比Z的氢化物沸点高 | |
| D. | 室温时,WXY3在纯水存在沉淀溶解平衡 |
17.下列各组离子在水溶液中能发生反应的是( )
| A. | Ag+、Cl- | B. | H+、SO42- | C. | Na+、CO32- | D. | Ba2+、Cl- |
18.已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3↑+8AlO2-.某地区的雾霾中可能含有如下可溶性离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、HCO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
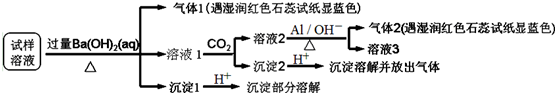
根据以上的实验操作与现象,该同学得出的结论错误的是( )

根据以上的实验操作与现象,该同学得出的结论错误的是( )
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |