题目内容
9.下列说法不正确的是( )| A. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| B. | 乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素 | |
| C. | 淀粉与稀硫酸混合加热一段时间后,滴加碘水溶液变蓝,说明淀粉没有水解 | |
| D. | Na2SO4•10H2O失水时吸热,结晶时放热,因而该晶体可作储热材料实现化学能与热能相互转化 |
分析 A、依据甲苯以及苯甲酸的分子式,结合燃烧通式计算即可;
B、乙酸乙酯在H218O中水解,产物乙酸中含有18O同位素;
C、结论错误,淀粉可能没有水解,也可能没有完全水解;
D、Na2SO4•10H2O失水和结晶属于化学变化,能量转换形式为化学能和热能的转化.
解答 解:A、苯和苯甲酸的分子式分别为C6H6、C7H6O2,C7H6O2可看作C6H6•CO2,由分子式可知等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等,故A正确;
B、由酯类水解原理可知,乙酸乙酯在H218O中水解,产物乙酸中含有18O同位素,乙醇中没有18O同位素,故B正确;
C、淀粉遇碘变蓝色,淀粉可能没有水解,也可能没有完全水解,故C错误;
D、Na2SO4•10H2O失水和结晶属于化学变化,能量转换形式为化学能和热能的转化,故D正确;故选:C.
点评 本题考查乙酸乙酯的水解原理、有机物燃烧耗氧量的判断等,注意晶体的结晶和失水均属于化学变化.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
20.X、Y、Z、W是原子序数依次增大的前20号元素,X、Y同周期,Y、Z同主族,X原子的最外层电子数为内层电子数的2倍,Y是地壳中含量最多的元素,W为金属元素,且原子中无成单电子,下列叙述不正确的是( )
| A. | Z的离子半径比W的离子半径小 | |
| B. | 第一电离能:X<Y | |
| C. | Y的氢化物的沸点比Z的氢化物沸点高 | |
| D. | 室温时,WXY3在纯水存在沉淀溶解平衡 |
17.下列各组离子在水溶液中能发生反应的是( )
| A. | Ag+、Cl- | B. | H+、SO42- | C. | Na+、CO32- | D. | Ba2+、Cl- |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 1mol SiO2晶体中含NA个SiO2分子 | |
| C. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
1.下列有关化学实验的叙述正确的是( )
| A. | 用容量瓶配制溶液时,必须先用该溶液润洗 | |
| B. | 在蒸馏实验时常加入碎瓷片以防止暴沸 | |
| C. | 可用碱式滴定管量取20.00mLKMnO4溶液 | |
| D. | 分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 |
18.已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3↑+8AlO2-.某地区的雾霾中可能含有如下可溶性离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、HCO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
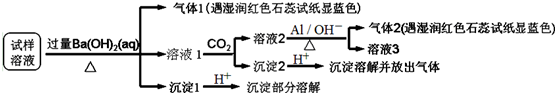
根据以上的实验操作与现象,该同学得出的结论错误的是( )

根据以上的实验操作与现象,该同学得出的结论错误的是( )
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |
19.下列说法正确的是( )
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、光导纤维、太阳能电池板等 | |
| C. | pH计不能用于酸碱中和滴定终点的判断 | |
| D. | 2013年11月22日,中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |