题目内容
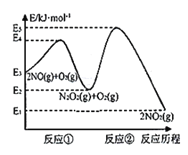
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
【答案】A
【解析】
A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物时放出的热量,反应①101kPa时,C(s)+![]() O2(g)=CO(g)△H1=-110.5kJ/mol为碳不完全燃烧,完全燃烧放出的热量比不完全燃烧放出的热量多,放热反应焓变小于0,放出的热量越多,焓变越小,若碳的燃烧热用△H3来表示,则△H3<△H1,故A正确;
O2(g)=CO(g)△H1=-110.5kJ/mol为碳不完全燃烧,完全燃烧放出的热量比不完全燃烧放出的热量多,放热反应焓变小于0,放出的热量越多,焓变越小,若碳的燃烧热用△H3来表示,则△H3<△H1,故A正确;
B.根据A项分析,则△H3<△H1,故B错误;
C.中和热是指稀溶液中强酸和强碱生成1molH2O放出的热量,稀硫酸与稀Ba(OH)2溶液反应生成2mol水,同时还生成硫酸钡沉淀,则放出大于2×57.3kJ的热量,故C错误;
D.中和热是指稀溶液中强酸和强碱生成1molH2O放出的热量,醋酸是弱酸,电离时需要吸收热量,则放出的热量小于57.3kJ,故D错误;
答案选A。

练习册系列答案
相关题目