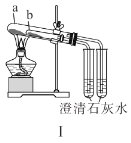
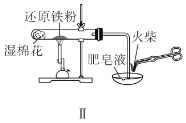
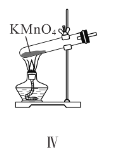
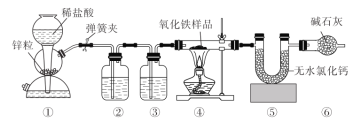
题目内容
【题目】研究氮氧化物等大气污染物对打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g),其反应历程分两步:
2NO2(g),其反应历程分两步:
①2NO(g)![]() N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反应) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反应) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
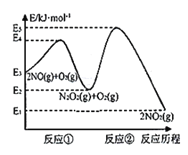
反应历程的能量变化如图:
请回答下列问题:
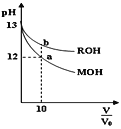
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=___。
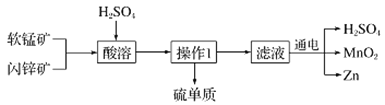
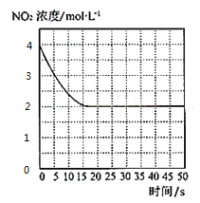
(4)T1℃下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如图所示。前5秒内O2的平均生成速率为___;T1℃下反应2NO(g)+O2(g)![]() 2NO2(g)的化学平衡常数K=__。
2NO2(g)的化学平衡常数K=__。
(5)对于(4)中的反应体系达平衡后,若降低温度,再次达平衡后,混合气体的平均相对分子质量___(填“增大”、“减小”或“不变”);对于(4)中的反应体系达平衡后,若在恒温恒容条件下,追加NO2,再次达平衡后,NO2的体积分数___(填“增大”、“减小”或“不变”)。
(6)对于(4)中的反应体系达平衡后(压强为P1),若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,P1︰P2 = 5︰8,则再次平衡时NO2的浓度为___mol·L-1。(精确到小数点后两位)
【答案】< < ![]() 0.1mol·L-1·s-1 1 增大 增大 2.67
0.1mol·L-1·s-1 1 增大 增大 2.67
【解析】
(1)该反应ΔH=E1-E3>0,故答案为:<;
(2)反应①的活化能为E4-E2,反应②的活化能为E5-E3,根据题意可知反应②的活化能大于反应①的活化能为,即E4-E2< E5-E3,故E4+E2<E5+E3,故答案为:<;
(3)该反应平衡常数![]() ,反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),所以
,反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),所以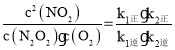 ,故答案为:
,故答案为:![]() ;
;
(4)前5s内![]() ,则v(O2)=0.1mol/(L·s)。利用三段式:
,则v(O2)=0.1mol/(L·s)。利用三段式:
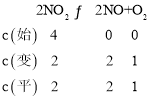
所给反应平衡常数![]() ;故答案为:0.1mol·L-1·s-1;1;
;故答案为:0.1mol·L-1·s-1;1;
(5)平均相对分子质量![]() ,反应
,反应![]() 为放热反应,降低温度,平衡右移,总质量不变,但气体总物质的量减小,故平均相对分子质量增大;恒温恒容条件下追加NO2, NO2浓度增大,根据勒夏特列原理可知虽然平衡左移,但NO2浓度依然增大,故答案为:增大;增大:
为放热反应,降低温度,平衡右移,总质量不变,但气体总物质的量减小,故平均相对分子质量增大;恒温恒容条件下追加NO2, NO2浓度增大,根据勒夏特列原理可知虽然平衡左移,但NO2浓度依然增大,故答案为:增大;增大:
(6)恒温恒容条件下,压强之比等于气体总物质的量之比,由P2,P1︰P2 = 5︰8可知充入氧气前后气体总物质的量之比为5︰8,设容器体积为V,则充入氧气前气体总物质的量为(2+2+1)V,所以再次达到平衡时物质的量为8V,设再次达到平衡时NO2浓度为amol/L,则充入氧气后反应![]() 平衡右移转化的NO为(a-2)mol/L,平衡时NO浓度为(4-a)mol/L,氧气的浓度为8-(4-a)-a=4mol/L,由于温度不变,故平衡常数K不变,K=1,所以
平衡右移转化的NO为(a-2)mol/L,平衡时NO浓度为(4-a)mol/L,氧气的浓度为8-(4-a)-a=4mol/L,由于温度不变,故平衡常数K不变,K=1,所以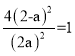 ,解得a≈2.67mol/L,故答案为:2.67。
,解得a≈2.67mol/L,故答案为:2.67。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案