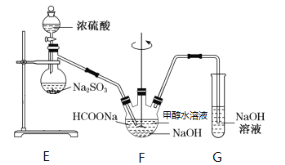
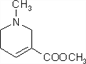
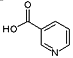
题目内容
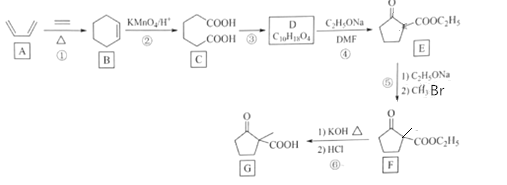
【题目】某同学设计了一种电解法制取Fe(OH)2的实验装置(如图),分别用铁棒和碳棒作电极,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中错误的是
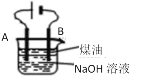
A.NaOH溶液加热煮沸以除去其中溶解氧
B.A电极用碳棒,B电极用铁棒
C.B电极发生的反应是:2H2O+2e- = H2↑+ 2OH-
D.电解池中的电解液也可以用NaCl溶液
【答案】B
【解析】
A.该电解池装置中,铁作阳极,失电子,转化为亚铁离子,与电解质溶液中的氢氧根离子结合形成氢氧化亚铁白色沉淀,氢氧化亚铁不稳定,易被氧化,故NaOH溶液加热煮沸以除去其中溶解氧,防止氢氧化亚铁氧化,故A正确;
B.利用该电解池装置制备氢氧化亚铁,铁作阳极与电源正极相连,碳作阴极,与电源负极相连,则A电极用铁棒,B电极用碳棒,故B错误;
C.B为电解池阴极,电极用碳棒,发生还原反应,B电极发生的反应是:2H2O+2e- = H2↑+ 2OH-,故C正确;
D.电解池中的电解液用NaCl溶液,根据放电顺序,阴极为电解水电极反应为2H2O+2e- = H2↑+ 2OH-,产生氢氧根,阳极铁电极失电子变为亚铁离子,二者电极产物结合可生成氢氧化亚铁,则电解池中的电解液也可以用NaCl溶液,故D正确;
答案选B。

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目