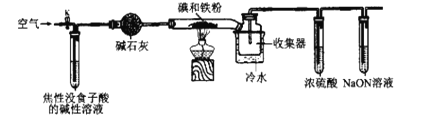
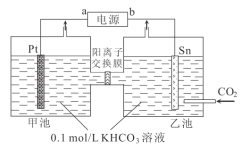
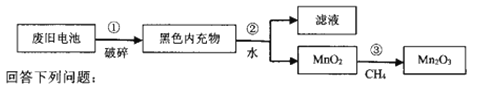
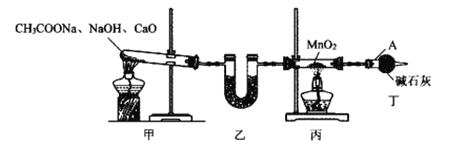
题目内容
【题目】Zn(OH)2、ZnS分别为白色、淡黄色难溶物,二者溶解度均随温度升高而增大。某温度下,Ksp[Zn(OH)2]=1.0×10-18。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加ZnSO4溶液,溶液中阳离子、阴离子浓度关系如图所示。图中p(Zn)=-lgc(Zn2+),p(B)=-lgc(OH-)或-1gc(S2-)。下列说法错误的是( )
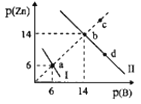
A.曲线l表示的是Zn2+与OH-浓度关系的曲线
B.该温度下,Ksp(ZnS)=1.0×10-28
C.升高温度时,b点一定会向c点移动
D.已知此温度下Ka2(H2S)═4.0×10-16,向0.01molL-lNaHS溶液中滴加等体积0.2molL-1ZnSO4溶液不能产生沉淀
【答案】CD
【解析】
A. 若曲线I表示的是Zn2+与OH-浓度关系的曲线,则a点时c(Zn2+)=c(OH-)=10-6mol/L,Ksp[Zn(OH)2]=10-6×(10-6)2=1.0×10-18,所以假设成立,即曲线表示的是Zn2+与OH-浓度关系的曲线,故A正确;
B.曲线I表示的是Zn2+与OH-浓度关系的曲线,则曲线II表示的是Zn2+与S2-浓度关系的曲线,b点时c(Zn2+)=c(S2-)=10-14mol/L,Ksp(ZnS)=c(Zn2+)c(S2-)=10-14×10-14=1.0×10-28,故B正确;
C.曲线II表示的是Zn2+与S2-浓度关系的曲线,ZnS溶解吸热,升高温度时溶液中c(Zn2+)、c(S2-)增大,则p(Zn)、p(B)减小,即升高温度时,b点一定会沿着ba方向向a点移动,故C错误;
D.等体积混合瞬间,NaHS浓度为0.005molL-l、ZnSO4浓度为0.1molL-1,c(S2-)=![]() mol/L=1.4×10-9mol/L,浓度熵Qc=c(Zn2+)c(S2-)=1.4×10-9×0.1=1.4×10-10mol>1.0×10-28=Ksp(ZnS),所以产生ZnS沉淀,故D错误;
mol/L=1.4×10-9mol/L,浓度熵Qc=c(Zn2+)c(S2-)=1.4×10-9×0.1=1.4×10-10mol>1.0×10-28=Ksp(ZnS),所以产生ZnS沉淀,故D错误;
答案选CD。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案