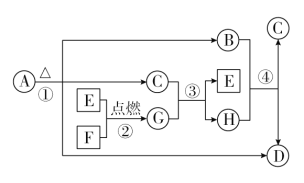
题目内容
【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
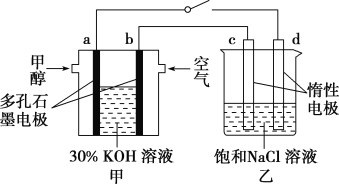
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。
【答案】CO2+2NH3![]() CO(NH2)2+H2O CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 1.6 mol 0.16 mol·L-1·min-1 < de CH3OH-6e-+8OH-=CO32-+6H2O 14
CO(NH2)2+H2O CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 1.6 mol 0.16 mol·L-1·min-1 < de CH3OH-6e-+8OH-=CO32-+6H2O 14
【解析】
(1)CO2与NH3合成尿素,其反应方程式为CO2+2NH3![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
答案为CO2+2NH3![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
(2)22.0 g CO2的物质的量为![]() =0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,即n(CO2)∶n(NaOH)=2∶3,此时的热化学方程式为2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1 Ⅰ;n(CO2)=1.0 mol,n(NaOH)=1.0 mol·L-1×2.0 L=2.0 mol,即n(CO2)∶n(NaOH)=1∶2,此时的热化学方程式为2NaOH(aq)+CO2(g)=Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1 Ⅱ;根据盖斯定律,Ⅰ-Ⅱ可得目标热化学方程式:NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
=0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,即n(CO2)∶n(NaOH)=2∶3,此时的热化学方程式为2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1 Ⅰ;n(CO2)=1.0 mol,n(NaOH)=1.0 mol·L-1×2.0 L=2.0 mol,即n(CO2)∶n(NaOH)=1∶2,此时的热化学方程式为2NaOH(aq)+CO2(g)=Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1 Ⅱ;根据盖斯定律,Ⅰ-Ⅱ可得目标热化学方程式:NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
答案为NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1;
(3)根据化学方程式中CH4与H2O的化学计量数的关系可计算c(CH4)=![]() =0.8 mol·L-1,平衡时容器中的甲烷的物质的量n(CH4)=0.8 mol·L-1×2 L=1.6 mol;v(CH4)=
=0.8 mol·L-1,平衡时容器中的甲烷的物质的量n(CH4)=0.8 mol·L-1×2 L=1.6 mol;v(CH4)=![]() =0.16 mol·L-1·min-1;300 ℃时,平衡常数K=
=0.16 mol·L-1·min-1;300 ℃时,平衡常数K=![]() =25>16,即300 ℃时的平衡常数比500 ℃时大,由此可见升温时,平衡逆向移动,故正反应为放热反应,即ΔH<0;
=25>16,即300 ℃时的平衡常数比500 ℃时大,由此可见升温时,平衡逆向移动,故正反应为放热反应,即ΔH<0;
答案为1.6 mol;0.16 mol·L-1·min-1;<;
(4)①a、消耗H2,生成CH3OH,反应方向都是向正反应方向进行,因此消耗3molH2,生成1molCH3OH,不能说明反应达到平衡,故a不符合题意;
b、反应的任何时间,都有转移3mol电子时,反应的CO2为11.2L(标况下),不能说明反应达到平衡,故b不符合题意;
c、组分都是气体,气体总质量不变,容器为恒容,气体体积不变,因此气体密度不变,不能说明反应达到平衡,故c不符合题意;
d、根据化学平衡的定义,当水蒸气的体积分数不再改变,说明反应达到平衡,故d符合题意;
e、生成H2,反应向逆反应方向进行,生成H2O,反应向正反应方向进行,且3:1等于化学计量数之比,因此单位时间内生成H2(g)与生成H2O(g)的物质的量比为3∶1,能说明反应达到平衡,故e符合题意;
答案为de;
②负极上CH3OH被氧化生成CO2,CO2与溶液中的OH-反应生成CO32-,故负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;电解饱和食盐水的阴极反应式为2H2O+2e-=2OH-+H2↑,转移0.12 mol电子时,生成的n(NaOH)=n(e-)=0.12 mol,c(OH-)=![]() =1 mol·L-1,c(H+)=
=1 mol·L-1,c(H+)= =10-14 mol·L-1,pH=-lg10-14=14;
=10-14 mol·L-1,pH=-lg10-14=14;
答案为CH3OH-6e-+8OH-=CO32-+6H2O;14。

【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________