题目内容
【题目】A~H为中学化学中常见的物质,其转化关系如图所示,其中“〇”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题:

(1)G的化学式为________,G中阴阳离子个数比为______,每生成1mol G转移电子物质的量为________ 。
(2)A、D的水溶液均呈_______(填酸性、碱性或中性),反应①②③④中属于氧化还原反应的有_______个。
(3)写出下列反应的化学方程式。
A→B+C+D:__________________,
F+C:__________________。
【答案】Na2O2 1﹕2 2mol 碱性 2 2NaHCO3![]() Na2CO3+H2O+CO2↑ 2Na+2H2O=2NaOH+H2↑
Na2CO3+H2O+CO2↑ 2Na+2H2O=2NaOH+H2↑
【解析】
F为金属单质,F与F点燃产生的化合物G为淡黄色固体,化合物C在通常状况下为无色液体,二者反应生成气体单质E与化合物H,则G是Na2O2,C是H2O,H为NaOH,E是O2,由反应②可知单质F为Na。根据反应④可知D中含有Na元素,A是医疗上治疗胃酸过多的一种药剂,加热分解生成水、B及含Na元素化合物D,可推知A是NaHCO3,B为CO2,D为Na2CO3,二氧化碳与氢氧化钠反应生成碳酸钠与水,符合转化关系,据此解答。
根据上述推断可知A是NaHCO3,B为CO2,C是H2O,D为Na2CO3,E是O2,F为Na,G是Na2O2,H为NaOH;
(1)G的化学式为Na2O2,G中阴、阳离子分别是O22-、Na+,二者的个数比为1:2,每生成1mol G,反应过程中转移电子物质的量为2mol;
(2) A是NaHCO3,D为Na2CO3,它们的水溶液均呈碱性,在反应①②③④中,①是NaHCO3分解产生Na2CO3和H2O、CO2,没有元素化合价的变化,不属于氧化还原反应;②是由单质参加的化合反应,元素化合价发生了变化,属于氧化还原反应;③是Na2O2与H2O反应产生NaOH和O2,有元素化合价的变化,属于氧化还原反应;④是NaOH与CO2反应产生Na2CO3和H2O,没有元素化合价的变化,不属于氧化还原反应,故属于氧化还原反应的有2个;
(3)A→B+C+D的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
F+C的反应是Na与H2O反应产生NaOH和H2,反应的方程式是:2Na+2H2O=2NaOH+H2↑。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
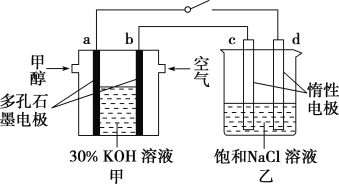
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。