题目内容
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________
【答案】导电 导热 B 钝化 因为钛的密度低且强度最高 铝的表面有一层致密的氧化膜 铝的密度比钢轻,车身会比较轻,铝的强度比钢低,容易被塑造成型;(合理即可) 铝的强度比钢低,铝表面有氧化膜,不易进行焊接,铝价格比钢昂贵。(合理即可)
【解析】
金属的不同性质决定不同的用途,扬长避短,根据题中表格所给数据可分析其用途。
(1)典型的导电金属有银、铜、铝,作电线是利用了铝的导电性;
(2)铁具有良好的导热性,用作炊具是利用了铁的导热性;A项生成可以二氧化硫,大量二氧化硫的排放会污染环境,B项原料利用率高,生成物除硫酸铜外,只有水,所以选择B项;
(3) 常温下铁和浓硫酸发生钝化现象,形成致密的氧化物保护薄膜,阻止反应的进一步进行,所以可用铁槽车运输浓硫酸;
(4) 由表中数据可以看出,钛的相对强度强且密度较低,所以选择钛作为制造飞机的材料之一;
(5)铝会与空气中的氧气反应生成一层致密的氧化物保护膜,所以铝耐腐蚀,铁与空气中氧气生成的铁锈疏松多孔,所以铁制品易锈透;
(6)铝与钢相比,铝的优点是:铝的密度比刚低,制作出的车比较轻可以降低油耗,铝的强度比钢低更柔软容易塑形;铝与钢相比,铝的缺点是:铝强度比钢低,若碰撞容易损坏,表面的氧化物保护膜耐高温不容易焊接,价格是铁的近三倍。

【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
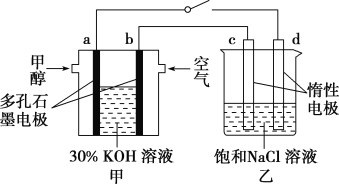
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。
【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。