题目内容
【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
【答案】B
【解析】
由表中数据可以知道△n(X)=1mol、△n(Y)=0.5mol、△n(W)=1.5mol,物质的量变化量之比等于化学计量数之比,所以△n(X):△n(Y):△n(W)=1mol:0.5mol:1.5mol=2:1:3,反应方程式为2X+Y3W;
A.升高温度W的体积分数减小,平衡向逆反应移动,因为升高温度平衡向吸热反应移动,则逆向为吸热反应,故正反应为放热反应,即△H<0,故A错误;
B.反应方程式为2X+Y 3W,反应前后气体的物质的量相同,可以利用物质的量代替浓度计算平衡常数,所以平衡常数![]() ,故B正确;
,故B正确;
C.该反应为反应前后气体的物质的量不变的反应,增大压强正、逆反应速率均增大相同的倍数,平衡不移动,故C错误;
D.该温度下,再向该容器中加入1.5molW,设Y变化物质的量为m
2X + Y 3W
起始量(mol) 1 0.5 1.5+1.5=3
变化量(mol) 2m m 3m
平衡量(mol) 1+2m 0.5+m 3-3m
根据W含量相同得到: ![]() m=0.25mol;
m=0.25mol;
则达到新平衡时![]() ,故D错误。答案选B。
,故D错误。答案选B。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
【题目】CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5~4.5 ℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响。如何合理地利用CO2是摆在科学家面前的一个重大课题。回答下列问题:
(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为___。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 | NaOH溶液的量 | 放出的热量 | |
① | 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
② | 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式: ___________________。
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g) ΔH。当300 ℃时,一定量的CO2和H2混合气体在容积为2 L的恒容密闭容器中发生上述反应,5 min后达到平衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0.8 | a | 1.6 |
则平衡时容器中甲烷的物质的量n(CH4)=________。从反应开始到达到平衡时的化学反应速率v(CH4)=__________。500 ℃时该反应的平衡常数K=16,则该反应的ΔH__________(填“>”“<”)0。
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①在容积为2 L的恒容密闭容器中,通入2 mol CO2和3 mol H2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__________(填字母)。
a.消耗3 mol H2(g)时,有1 mol CH3OH(g)生成
b.转移3 mol电子时,反应的CO2为11.2 L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3∶1
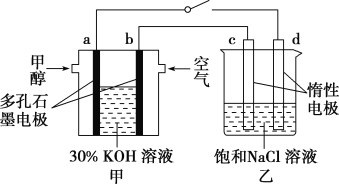
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为______________________________。若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12 mol 电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120 mL,则此时乙装置中溶液的pH=________(假设食盐水中有足量的NaCl,且Cl2完全逸出)。