题目内容
工业上常用SiO2与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1。下列说法正确的是( )
A.硅元素在地壳中含量居第二位,主要以单质硅和硅酸盐的形式存在
B.纯净的SiO2只能用于制造光导纤维
C.SiC因有很高的化学稳定性和热稳定性,故可用作高温结构陶瓷材料。
D.制造粗硅时的上述反应方程式为:2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
练习册系列答案
相关题目
15.保护环境是每个公民的责任.以下做法①推广使用无磷洗涤剂;②推广使用一次性木质筷子;③过量使用化肥、农药;④推广使用清洁能源;⑤落叶积极清扫并焚烧;⑥严格控制污水按标准排放.其中有利于保护环境的是( )
| A. | ①④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ②③⑥ |
14.下表中的实验能达到实验目的或能取出相应结论的是( )
| 选项 | 实验目的 | 实验目的或结论 |
| A | 向含有少量FeCl2的MgCl2溶液中加入足量NaOH溶液,搅拌后静置过滤 | 除去MgCl2溶液中少量FeCl2 |
| B |  | NaHCO3比Na2CO3受热更易分解 |
| C | 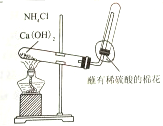 | 制取并收集氨气 |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌,过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
17.浓硫酸与锌在一定条件下反应,若在反应过程中,锌与硫酸的质量比为26:49,则硫酸的还原产物为( )
| A. | SO2 | B. | S | C. | H2S | D. | ZnSO4 |
1.400℃时,向容积为2L的密闭容器中充入1.2mol 的A和0.6mol 的B,发生反应如下:A(g)+B(g)?C(g)+D(g).t分钟后反应达到平衡,此时测得A的物质的量为0.8mol.下列说法正确的是( )
| A. | 反应在tmin内的平均速率为v(D)=0.4/tmol•L-1•min-1 | |
| B. | 温度升至500℃时,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,向平衡体系中再通入0.2molB,与原平衡相比,达到新平衡时A转化率增大,B的体积分数增大 | |
| D. | 若反应开始时向密闭容器中充入2.4mol 的A和1.2mol 的B,达到平衡所需时间小于t |


 剂
剂 谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。
谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。 SCN溶液,溶
SCN溶液,溶