题目内容
【题目】(1)利用反应![]() 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
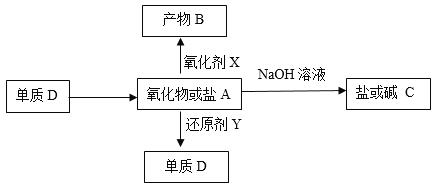
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
【答案】 ![]()
![]() bd 变小 CuO或CuCO3 Cu(OH)2或Cu2(OH)2CO3或CuO和H2O 4mol(或6mol)
bd 变小 CuO或CuCO3 Cu(OH)2或Cu2(OH)2CO3或CuO和H2O 4mol(或6mol)
【解析】分析:(1)根据铜失去电子,氧气得到电子解答;
(2)根据亚铁离子能与K3[Fe(CN)6]反应产生蓝色沉淀解答;
(3)a、反应中有热能产生;b、精炼铜时,粗铜做阳极;c、溶液中Cu2+向阴极移动;d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落;
(4)用惰性电极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,据此解答。
详解:(1)根据总反应式可知铜失去电子,氧气得到电子,因此负极是铜,氧气在正极通入,由于有稀硫酸参加反应,则其正极电极反应式为O2+4e-+4H+=2H2O;
(2)亚铁离子能与K3[Fe(CN)6]反应产生蓝色沉淀,因此检验溶液中是否存在Fe2+的最好的方法是用K3[Fe(CN)6],反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。
(3)a、反应中有热能产生,电能不能全部转化为化学能,a错误;b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,b正确;c、电解池溶液中Cu2+向阴极移动,c错误;d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,d正确;答案选bd;
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,说明阴极是铜离子放电,阳极是氢氧根放电,从而产生氢离子,则所得溶液的pH变小。生成物是硫酸、铜和氧气,因此要使电解质溶液恢复到电解前的状态,可加入CuO或CuCO3;若阴阳两极均有气体生成,说明阴极还有氢离子放电产生氢气,所以要使电解质恢复到电解前的状态,可加入Cu(OH)2或或CuO和H2O;如果加入的1mol物质是Cu(OH)2,将氢氧化铜化学式改变为CuOH2O,所以加入1molCu(OH)2就相当于加入1molCuO和1mol水。第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=1mol,转移电子的物质的量=1mol×2=2mol;第二阶段:电解生成1mol水转移电子的物质的量=1mol×2=2mol,所以电解过程中共转移的电子数为2mol+2mol=4mol;如果加入的是1molCu2(OH)2CO3,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入1molCu2(OH)2CO3就相当于加入2molCuO和1mol水。第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=2mol,转移电子的物质的量=2mol×2=4mol;第二阶段:电解生成1mol水转移电子的物质的量=1mol×2=2mol,所以电解过程中共转移的电子数为4mol+2mol=6mol。

【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
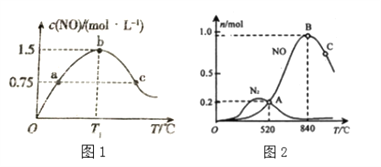
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。