��Ŀ����
����Ŀ��ijͬѧ��ѧϰԪ�ػ�����֪ʶ�Ĺ����У������о�����A����ͨ�����µĽǶ�չ��������A��B��C��D��E�о�����Ԫ�ء�

��ش�
��1������Ԫ��Ϊ������Ԫ�أ�����DΪ��ɫ���壬A�������
�� ��Ԫ����Ԫ�����ڱ��е�λ����______��
�� ������A������NaOH��Һ��Ӧ�����ӷ���ʽ��______��
��2����DΪ������AΪ�Σ�����B��KSCN��Һ�ʺ�ɫ��
������˵����ȷ����______������ĸ����
a������D�������������ᡢ�����������ᷴӦ������A
b����A��NaOH��Һ��Ӧʱ�������ڿ����в��ȶ����ױ�O2����
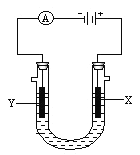
c����ԭ��Y��ѡ��ͭ
����������XΪ���Ը��������Һ��5.6 g ����Dȫ��ת��Ϊ����Bʱ��ת�Ƶ��ӵ����ʵ���Ϊ______mol��
���𰸡� �������ڵڢ�A�� SO2�� OH�� ![]() HSO3�� b 0.3
HSO3�� b 0.3
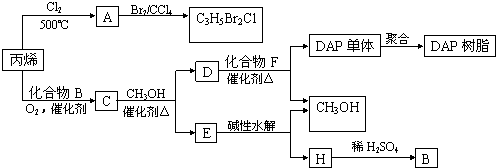
������������A��B��C��D��E�о�����Ԫ�أ�������ʵ����ʺ�ת����ϵͼ���
��1������Ԫ��Ϊ������Ԫ�أ�����DΪ��ɫ���壬���D��S��A�������A�Ƕ���������
����Ԫ�ص�ԭ��������16����Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�塣
�ڶ�������������NaOH��Һ��Ӧ�������������ƣ���Ӧ�����ӷ���ʽ��SO2��OH����HSO3����
��2����DΪ������AΪ�Σ�����B��KSCN��Һ�ʺ�ɫ��B�к��������ӣ�����D������A�������Σ�B�����Ρ���
��a�������������ᷴӦ�������������ò�������������a����b����������NaOH��Һ��Ӧʱ�����ɵ������������ڿ����в��ȶ����ױ�O2������������������b��ȷ��c����������ǿ��ͭ��ͭ�����û���������ԭ��Y����ѡ��ͭ��c����ѡb��
����������XΪ���Ը��������Һ��5.6 g �����������ʵ�����0.1mol��ȫ��ת��Ϊ����Bʱ����Ԫ�ػ��ϼ۴�0�����ߵ�+3�ۣ�ת�Ƶ��ӵ����ʵ���Ϊ0.3mol��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�