题目内容
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJmol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
【答案】 CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-764.7 kJ/mol E1-E2 -285.9 kJ/mol +1275.6kJmol﹣1 O2+4H++4e-=2H2O 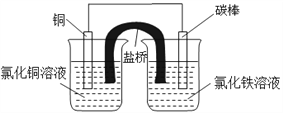
【解析】分析:(1)根据盖斯定律书写;
(2)根据ΔH=E生成物-E反应物计算;
(3)在一定条件下,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量是燃烧热,据此判断;
(4)根据盖斯定律书写;
(5)根据原电池中正极发生得到电子的还原反应分析;
(6)该反应中,Cu失去电子,作负极,铁离子得到电子,在正极放电,以此解答该题。详解:(1)已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
则根据盖斯定律可知①+②即得到甲醇蒸气完全燃烧的热化学反应方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-764.7 kJ/mol。
(2)ΔH=E生成物-E反应物,则根据图像中的能量变化关系图可知ΔH2=(E1-E2)kJ/mol。
(3)根据2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol可知H2(g)的燃烧热为-285.9 kJ/mol。
(4)已知:
①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566kJmol﹣1
则根据盖斯定律可知-(②+①×2)即得到反应2CO2(g)+4H2O(g)=2CH3OH(l)+3O2(g)的△H=+1275.6kJmol﹣1;
(5)氧气在正极通入,得到电子,由于电解质溶液显酸性,则其正极反应可表示为O2+4H++4e-=2H2O;
(6)该反应中,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,比Cu不活泼的金属或导电的非金属作正极,氧化反应的烧杯中选择氯化铜为电解质,还原反应中选择FeCl3溶液为电解质溶液,装置图为 。
。

【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D