题目内容
【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
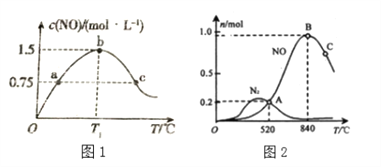
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。
【答案】 0.3mol/(L·min) C AD 75% II 该反应为放热反应,当温度升高,平衡向左(逆反应)移动 2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1
N2(g) +O2(g) △H= -180.8 kJ·mol-1
【解析】(1)①在第1min到第2min时,O2的平均反应速率=(1.35 mol/L-0.975 mol/L)/1 min=0.375 mol/(L·min), NH3的平均反应速率为氧气平均速率的4/5,则NH3的平均反应速率为0.375 mol/(L·min)×4/5=0.3mol/(L·min);由数据分析可知,反应在第3 min到4 min时,速率加快且反应逆向移动,又因此反应正反应是放热反应,故只有升高温度才满足条件。因为催化剂不影响平衡移动;减小压强,速率减慢;增加O2的浓度,平衡向正方向移动,均不符合实验数据得出的结论。故只有升高温度。③A.单位时间内生成n mol NO的同时生成n mol NH3,速率相等,方向相反,达到平衡,A正确;B.百分含量w(NH3)=w(NO),不一定达到平衡,故B错误;C.反应速率比等于计量数比,不一定达到平衡,故C错误;D.在恒温恒容的容器中,气体质量不变,反应前后气体分子数是变化量,当气体分子数不变,则混合气体的平均相对分子质量不再变化,说明反应达到平衡,故D正确,答案选AD。(2)因NO与NH3的计量数相等,T1℃时,c(NO)=1.5mol/L,则氨气的转化浓度为1.5mol/L,则 T1℃下,NH3的平衡转化率为1.5mol/L /2.0mol/L==75%。(3)①由图2分析可知,催化剂在低温时生成氮气比一氧化氮的量多,故催化剂在低温时选择反应II为主; ②该反应为放热反应,当温度升高,平衡向左(逆反应)移动,C点比B点所产生的NO的物质的量少;(4)由盖斯定律可知,(反应 II-反应I)/2,即得到NO分解生成N2与O2的方程式,则NO分解生成N2与O2的热化学方程式:2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1。
N2(g) +O2(g) △H= -180.8 kJ·mol-1。

 期末集结号系列答案
期末集结号系列答案