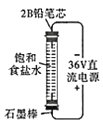
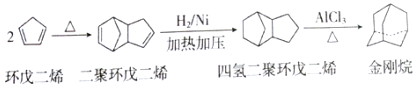
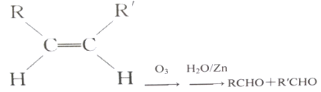题目内容
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
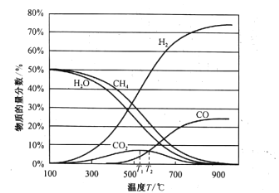
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
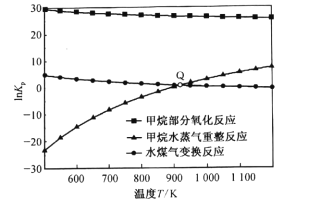
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
【答案】> +75 增大起始时![]() (或及时从产物中分离出氢气) 反应Ⅱ为放热反应,从T1℃升高温度,平衡向逆反应方向移动的因素大于CO浓度增大向正反应方向移动的因素,净结果是平衡逆向移动 7(或7:1) 0 0.5 -0.3
(或及时从产物中分离出氢气) 反应Ⅱ为放热反应,从T1℃升高温度,平衡向逆反应方向移动的因素大于CO浓度增大向正反应方向移动的因素,净结果是平衡逆向移动 7(或7:1) 0 0.5 -0.3
【解析】
(1)①气体体积增大的过程为熵增的过程,熵增过程△S大于0,反之小于0,反应I为CH4(g)=C(s)+2H2(g),气体物质的量增大,混乱度增大,属于熵增的过程,△S>0;
②已知:Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
根据盖斯定律,Ⅲ×3-Ⅱ可得:C6H6(g)+3H2(g)=3C2H4(g) △H=(+202kJ/mol)×3-(+531kJ/mol)=+75 kJ/mol;
(2)①为提高CH4的平衡转化率,即要让反应向正向进行,除压强、温度外,还可将生成的氢气从产物中分离出去,或增大起始时的![]() ;
;
②反应Ⅰ是吸热反应,升高温度,平衡正向移动,CO的浓度增大,反应Ⅱ为放热反应,升高温度,反应逆向进行,CO2的量减少,出现如图所示CO2的物质的量分数开始减小,说明T1℃升高温度,平衡向逆向移动的因素大于CO浓度增大向正向移动的因素,结果是平衡逆向移动;
③根据图像,T2℃时,容器中一氧化碳和二氧化碳的物质的量分数相等,设T2℃时,二氧化碳的物质的量为x,列三段式:
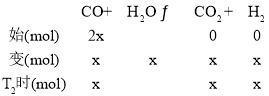
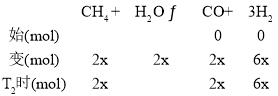
根据上述分析,T2℃时,n(H2)=6x+x=7x,n(CO2)=x,则![]()
![]() =7;
=7;
(3)①图中Q点时,甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp相等,即压强平衡常数相等,则 ,可得
,可得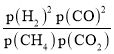 =1;则反应
=1;则反应![]() 的压强平衡常数Kp=
的压强平衡常数Kp=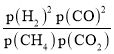 =1,则lnKp=ln1=0;
=1,则lnKp=ln1=0;
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1atm。根据反应![]() ,则平衡时n(CH4)=lmol-lmol×50%=0.5mol,n(H2O)= lmol -lmol×50%=0.5mol,n(CO)=0.5mol,n(H2)=3×0.5mol=
,则平衡时n(CH4)=lmol-lmol×50%=0.5mol,n(H2O)= lmol -lmol×50%=0.5mol,n(CO)=0.5mol,n(H2)=3×0.5mol=![]() ×1atm=0.5 atm,用压强表示该反应的平衡常数Kp=
×1atm=0.5 atm,用压强表示该反应的平衡常数Kp=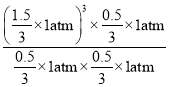 =
=![]() ,则lnKp=ln
,则lnKp=ln![]() = ln3- ln4=1.1-1.4=-0.3。
= ln3- ln4=1.1-1.4=-0.3。

 阅读快车系列答案
阅读快车系列答案【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |