题目内容
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣(主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等)为原料制备磷酸铝的工艺流程如图所示:

回答下列问题:
(1)酸浸液中含磷元素的主要粒子是_____(填化学式,下同),浸渣中的主要化学成分是_____。
(2)生石灰除了调节pH外,另一作用是_____。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为_____。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是_____ (填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示:

则最优反应条件是_____。
(6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:_____。
【答案】H3PO4 SiO2、CaSO4 除去过量的SO42- V3O93-+3H2O3[VO3(OH)]2-+3H+ Na[Al(OH)4]、Na3PO4 pH=12、温度为80℃、时间为1h Al2O3+2NH4H2PO4![]() 2AlPO4+2NH3↑+3H2O
2AlPO4+2NH3↑+3H2O
【解析】
磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4,酸浸液中加CaO可调节pH且除去过量硫酸根离子,滤渣1为CaSO4,滤液中钒元素以V3O93-形式存在,加NaOH分离出Na2[VO3(OH)],再加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4,由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al含量w%小,为最优反应条件,然后过滤分离出AlPO4;
(1)SiO2为酸性氧化物,不与硫酸反应;CaSO4微溶于水,据此回答;
(2)加浓硫酸引人过量的硫酸根离子,CaSO4微溶于水,据此回答;
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2;
(4)加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4;
(5)在pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图中,寻找碱浸时固相中P、Al 含量w%小时就为最优反应条件;
(6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O。
(1)酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为Ca3(PO4)2+3H2SO4=3CaSO4+2H3PO4,磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4;
(2)生石灰除了调节pH 外,另一作用是除去过量的硫酸根离子;
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2,该水解反应的离子方程式为V3O93-+3H2O3[VO3(OH)]2-+3H+;
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是Na[Al(OH)4]、Na3PO4;
(5)由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al 含量w%小,为最优反应条件;
(6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O,化学方程式为:Al2O3+2NH4H2PO4![]() 2AlPO4+2NH3↑+3H2O.
2AlPO4+2NH3↑+3H2O.

【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
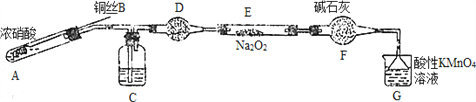
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。