题目内容
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
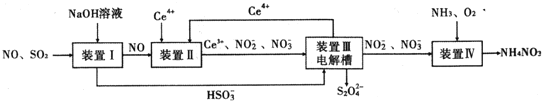
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______.
(2)含硫各微粒(H2SO3、![]() 和
和![]() )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
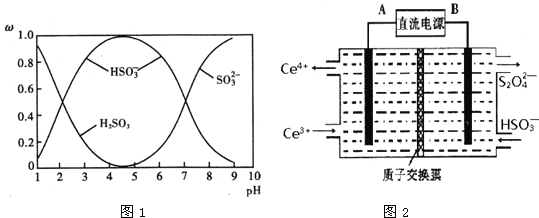
①下列说法正确的是______(填标号).
A.pH=7时,溶液中c(Na+)=3c(![]() )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(![]() )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______.
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.
【答案】NO+H2O+Ce4+= Ce3++ NO2-+2H+ ABC 3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O 酸式 滴入最后一滴溶液呈紫红色且半分钟颜色不变 正 2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O 4480
【解析】
(1)装置Ⅱ中NO和Ce4+在酸性条件下生成Ce3+和NO2-,根据氧化还原反应书写离子方程式。
(2)根据电荷守恒和图像及溶液的pH分析;根据物质的量的比例关系书写离子方程式;高锰酸钾装在酸式滴定管里,当最后一滴滴入,溶液变为紫红色,且半分钟内不变为原来颜色。
(3)根据化合价分析得到化合价升高,应在阳极反应,连接电源正极,右侧发生化合价降低的反应。
(4)亚硝酸根化合价升高,氧气化合价降低,根据升降守恒得出氧气的物质的量。
(1)装置Ⅱ中NO和Ce4+在酸性条件下生成Ce3+和NO2-的离子方程式NO+H2O+Ce4+= Ce3++ NO2-+2H+,故答案为:NO+H2O+Ce4+= Ce3++ NO2-+2H+。
(2)①A选项,根据电荷守恒和pH=7时,c(HSO3-) = c(SO32-),因此溶液中c(Na+)= c(HSO3-) +2 c(SO32-) =3 c(HSO3-),故A正确;
B选项,由图中数据,pH=7时,c(HSO3-) = c(SO32-),因此估算出H2SO3的第二级电离平衡常数Ka2≈10-7,故B正确;
C选项,由图1可知,为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜;
D选项,pH = 9时溶液为亚硫酸钠和亚硫酸氢钠混合溶液,无法得出溶液中c(OH-)=c(H+) + c(HSO3-) +c(H2SO3),故D错误。
综上所述,答案为ABC。
②1L 1mol/L的NaOH溶液中含NaOH的物质的量为1 mol,NaOH完全吸收13.44L(标况下)SO2即0.6molSO2,NaOH和SO2的物质的量之比为5:3,则反应的总离子方程式为3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O,故答案为:3SO2 + 5OH- = 2SO32-+ HSO3- + 2H2O。
③酸性高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,因此应装在酸式滴定管中,判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变,故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变。
⑶装置Ⅲ的作用之一是再生Ce4+,在阳极反应生成Ce4+,阳极连接电源的正极,因此A为电源正极,右侧反应室中发生的主要电极反应式为2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O,故答案为:正;2HSO3- + 2e- +2 H+ = S2O42-+ 2H2O。
⑷已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,即n(NO2-)= 0.4mol/L×1000L = 400mol,亚硝酸根升高2个价态,氧气降低4个价态,因此需400mol亚硝酸根与200mol氧气反应,向装置Ⅳ中通入标准状况下的O2的体积为200mol ×22.4 L/mol =4480 L,故答案为:4480。

【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
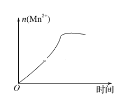
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
【题目】短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置_____________________,
E的原子结构示意图是________。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是____(填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式____。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为____,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___________。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___________________________________。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于____mol·L-1。
【题目】某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)该学习小组用pH试纸对上述0.5000 mol·L-1醋酸溶液进行了pH测定,请用文字描述pH试纸的使用方法______。
(3)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
则该醋酸溶液的浓度为________________。
(4)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。

①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为____________。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的_____倍;
(5)在滴定过程中,下列操作会造成结果偏高的是________。
A.滴定终点时,滴定管尖嘴处有半滴悬而未落
B.读取NaOH溶液体积时,开始仰视读数,滴定结束后俯视读数
C.滴定过程中向锥形瓶中加水
D.滴定管水洗后未用标准液润洗