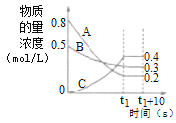
题目内容
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
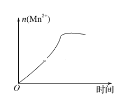
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
【答案】1 293 BC 3 其他条件相同,增大反应物浓度,反应速率增大 8.33×10-4mol/(Ls) 催化作用
【解析】
(1)探究外界条件对化学反应速率的影响实验时,两组实验中只有一个因素不同;
(2)若t1<8,对比实验A、B,温度相同,高锰酸钾的浓度相同,而草酸的浓度不同;
(3)根据图像中n(Mn2+)随时间的增大,迅速升高,进行解释。
(1)探究外界条件对化学反应速率的影响实验时,两组实验中只有一个因素不同,为不影响溶液混合导致浓度变化,则反应体系的总体相同,实验A,总体积为6mL,则V1=1mL,V2=3mL;实验B、C高锰酸钾及草酸的体积均相同,则探究温度不同时对反应速率的影响,还通过实验A、B对比试验探究浓度对化学反应速率的影响,则T1=293K;
(2)若t1<8,对比实验A、B,温度相同,高锰酸钾的浓度相同,而草酸的浓度不同,且A中浓度大于B的,则A的反应时间小于B,结论为:其他条件相同,增大反应物浓度,反应速率增大;v(KMnO4)=c/t=0.02×2/(6×8)=8.33×10-4mol/(Ls);
(3)根据图像中随时间的增大,n(Mn2+)迅速升高,表明生成的某粒子对该反应有催化作用,结合方程式,生成的产物为Mn2+,起催化作用。

【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。