题目内容
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )

A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
【答案】D
【解析】A、在曲线上任一点均存在电荷守恒:c(Na+)-c(OH-)=c(CH3COO-)-c(H+),选项A正确;B、点①所示溶液是醋酸和醋酸钠按1:1形成的溶液,电荷守恒有c(Na+) +c(H+)=c(CH3COO-)+c(OH-),物料守恒有2c(Na+)= c(CH3COO-)+ c(CH3COOH),前式代入后式得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项B正确;C、点②所示溶液呈中性,c(OH-)= c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),选项C正确;D、点③所示氢氧化钠与醋酸完全中和,为醋酸钠溶液,呈碱性:c(Na+)> c(CH3COO-)> c(OH-)>c (H+),选项D不正确。答案选D。

 名校课堂系列答案
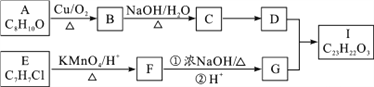
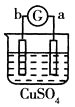
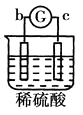
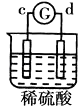
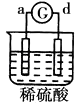
名校课堂系列答案【题目】有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
实验 |
|
|
|
|
部分实 | a极质量减小 | 溶液中的SO42﹣﹣向b极移动 | d极溶解c极 | 电子从d极 |
由此可判断这四种金属的活动性顺序是( )
A.d>a>b>c
B.a>b>c>d
C.b>c>d>a
D.a>b>d>c
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO ![]() 水解程度增大,故碱性增强,该反应的离子方程式为 .
水解程度增大,故碱性增强,该反应的离子方程式为 .
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3 , 并推断Na2CO3的水解程度NaHCO3(填“大于”或“小于”).丙同学认为甲、乙的判断都不充分.
(3)丙认为: 只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则(填“甲”或“乙”)判断正确.试剂X是(填选项).
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(4)将加热后的溶液冷却到10℃,若溶液的pH8.3(填“大于”“小于”或“等于”),则(填“甲”或“乙”)判断正确.
(5)查阅资料发现NaHCO3的分解温度为150℃,丙断言(填“甲”或“乙”)判断是错误的,理由是 .