题目内容
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含 T 的盐溶液一定能电离出 T 的阳离子
【答案】D
【解析】
由短周期元素R、T、Q、W所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素。A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性N>Si,非金属性越强,氢化物越稳定,故氢化物的稳定性:NH3>SiH4,故A正确;B.同周期自左而右非金属性增强,非金属性Si<S,非金属性越强,最高价含氧酸的酸性越强,所以酸性:H2SiO3<H2SO4,故B正确;C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;D.偏铝酸钠只能电离出钠离子和偏铝酸根离子,不能电离出铝离子,故D错误;故选D。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】对机动车尾气中的N元素、C 元素进行处理,可以保护环境,减少污染。
(1)汽缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
反应Ⅰ:NO(g)+CO(g)+Rh(s)![]() RhN(s)+CO2(g) △H=-8kcal·mol-1
RhN(s)+CO2(g) △H=-8kcal·mol-1
反应Ⅱ:RhN(s)+NO(g)![]() Rh(s)+N2O(g) △H =-76.4kcal·mol-1
Rh(s)+N2O(g) △H =-76.4kcal·mol-1
则由NO生成1mol N2O的△H =____kcal·mol-1。若Ⅰ比Ⅱ的反应速率大,下列能正确表示反应2NO(g)+CO(g)![]() N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____
N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____

⑵在体积为1L的恒温密闭容器中,发生反应:
2NO(g)+2CO (g) ![]() N2(g)+2CO2(g),有关物质的量如下表:
N2(g)+2CO2(g),有关物质的量如下表:
起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 |
0.2 | 0.2 | 0 | 0 | a |
①上述反应的化学平衡常数表达式K=__________
②若达到平衡后气体的压强为开始时的0.875倍,则a =______
⑶汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示。
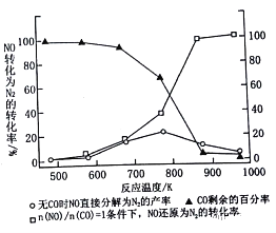
①在n(NO)/n(CO)=1条件下,最佳温度应控制在_____左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___
③用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大?______