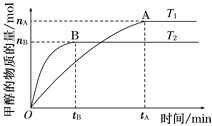
题目内容
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
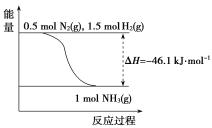
(2)根据下图,合成氨的热化学方程式是__________________________。
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
【答案】温度升高,氨在混合气体中的体积分数减小,平衡逆向移动,温度升高平衡向着吸热反应方向移动,故正反应是放热反应 N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1 小于 由于该反应是可逆反应,反应物无法全部转化为生成物 不变 391 N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
【解析】
(1)由表格中的数据可以知道温度升高,合成氨平衡混合气体中氨气的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动;
(2)由图可以知道1/2molN2(g),3/2mol H2(g) 完全反应生成1molNH3(g) 的反应热为-46.1kJ·mol-1,据此写出合成氨的热化学反应方程式;
(3)合成氨的反应为可逆反应,反应物无法全部转化为生成物;
(4)根据反应热=反应物断键吸收的总能量-生成物成键放出的总能量进行计算;
(5)根据盖斯定律进行计算。
(1)由表格数据可以知道温度升高,合成氨平衡混合气体中氨气的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应;
因此,本题正确答案是: 温度升高,氨在混合气体中的体积分数减小,平衡逆向移动,温度升高平衡向着吸热反应方向移动,故正反应是放热反应。
(2)由图可以知道1/2molN2(g),3/2mol H2(g) 完全反应生成1molNH3(g) 的反应热为-46.1kJ·mol-1,所以合成氨的热化学反应方程式为: N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1;
综上所述,本题答案是:N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1。
(3) 在一密闭容器中,合成氨的反应为可逆反应,反应物无法全部转化为生成物,所以取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2 kJ;若加入催化剂,能够加快反应速率,但不影响反应热,ΔH不变;综上所述,本题答案是:小于;由于该反应是可逆反应,反应物无法全部转化为生成物;不变。
(4)N2(g)+3H2(g) ==2NH3(g)ΔH=-92.2 kJ·mol-1,则破坏1molN—H键需要吸收的能量为xkJ,根据反应热=反应物断键吸收的总能量-生成物成键放出的总能量可知,-92.2=946+3×436-2×3×x,x=391kJ;综上所述,本题答案是:391。
(5)①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1,②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1,根据盖斯定律可知,②×2-①可知,2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-534×2-67.7=-1135.7 kJ·mol-1;所以1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1;综上所述,本题答案是:N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1。