题目内容
【题目】一种新型的双离子可充电电池的原理如图所示,以下说法正确的是

A. 电极a发生的反应为还原反应
B. 充电时a极与电源的正极相连
C. 正极发生的电极反应可能为:CaFeO3+e-=CaFeO2.5+1/2O2-
D. 放电时,每当有NA个Na+移向b极,外电路中一定转移2NA个电子
【答案】C
【解析】
A.由图可知,电极a发生的反应为Na-e-=Na+,为氧化反应,故A错误;
B.充电时a极发生的反应为Na++e-=Na,还原反应,则a为电解池的阴极,阴极与电源的负极相连,故B错误;
C.由图可知,电极b为正极,发生的电极反应可能为:CaFeO3+e-=CaFeO2.5+1/2O2-,故C正确;
D.放电时,每当有NA个Na+移向b极,外电路中转移NA个电子,故D错误。
故选C。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
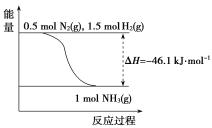
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。




